Culture media for seed germination and seedling growth of Laelia autumnalis
DOI:
https://doi.org/10.29312/remexca.v16i6.3811Keywords:
day of the dead orchid, MS medium, orchid seedlingsAbstract
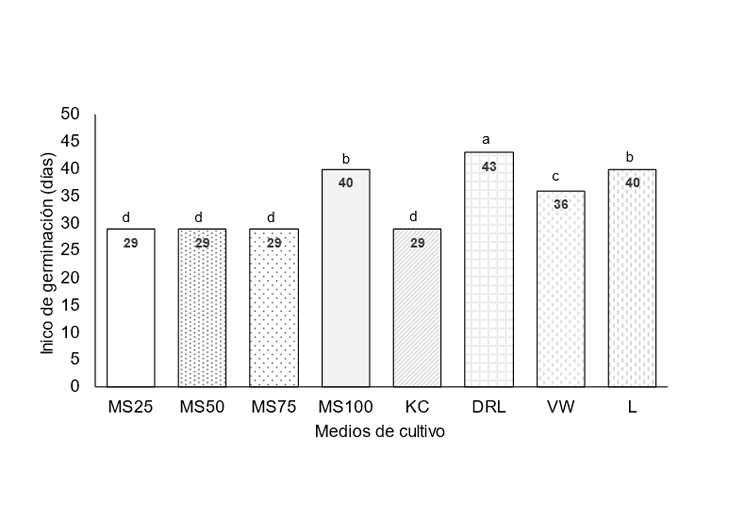
The orchid Laelia autumnalis is endemic to Mexico and is under special protection. In vitro culture has contributed to improving the propagation of orchids from seeds. In order to micropropagate this species, an experiment was established in 2023 to evaluate eight culture media: Murashige and Skoog (MS at 100, 75, 50 and 25%), Knudson C, Dalla Rosa and Laneri, Vacint and Went, and Lindemann; all media were supplemented with 0.5 mg L-1 thiamine HCl, 100 mg L-1 myo-inositol and 3% sucrose to determine the best medium for germination of this species. Seeds were disinfected with 0.3% sodium hypochlorite (NaClO) and sown in the media in a completely randomized design with 10 replications per treatment. Germination start and percentage were recorded; seedling height, leaf length and number, root number and length, and pseudobulb diameter were evaluated at 90 days. The 25 and 50% MS media generated a higher percentage of germination (84.57 and 72.54%, respectively), which began 29 days after seeding. Growth in height (5.6 mm), leaf length (4.54 mm) and root length (5.2 mm) were higher in the MS medium at 50%, where seedlings were green. It was concluded that the best culture medium for germination and growth of L. autumnalis seedlings was the MS at 50% concentration.
Downloads
References
Aguilar-Morales, M. A. y López-Escamilla, A. L. 2013. Germinación in vitro de Laelia speciosa (Kunth) Schltr., una herramienta para su conservación ex situ. In: estudios científicos en el estado de Hidalgo y zonas aledañas. Pulido F. G. y Monks S. (eds.) USA. Zea Books, University of Nebraska. Volumen II. 18-24 pp. https://digitalcommons.unl.edu/hidalgo.
Ávila-Diaz, I.; Oyama, K.; Gómez-Alonzo, C. and Salgado-Garciglia, R. 2009. In vitro propagation of the endangered orchid Laelia speciosa. Plant Cell Organ Culture. 99(3):332-343. Doi:10.1007/s11240-009-9609-8.
Castillo-Pérez, L. J.; Martínez-Soto, D.; Maldonado-Miranda, J. J.; Alonso-Castro, A. J. and Carranza-Álvarez, C. 2018. The endemic orchids of Mexico: a review. Eslovaquia. Biología. 74:1-13. Doi.org/10.2478/s11756-018-0147-x.
Dalla-Rosa, M. and Laneri, U. 1977. Modification of nutrient solutions for germination and growth “in vitro” of some cultivated orchids and for the vegetative propagation of Cymbidium cultivars. American Orchid Society Bulletin. 46(9):813-820.
Dalzotto, C. A. 2013. Efecto de medios de cultivo en el crecimiento in vitro de Oncidium bifolium sims. “federal”. Revista Científica Agropecuaria. 17(1-2):7-15.
De Menezes, G. L.; Machado, M. F.; Ballesta, P.; Mora, F.; Milaneze, G. M. A. y Mangolin, C. A. 2016. Suplementos orgánicos para el cultivo in vitro del híbrido Laeliocattleya (Orchidaceae). Chile. Idesia (Arica). 34(1):47-54. https://dx.doi.org/10.4067/S0718- 34292016000100006.
DOF. 2019. Diario Oficial de la Federación. Modificación del anexo normativo III, lista de especies en riesgo de la Norma Oficial Mexicana NOM-059-SEMARNAT-2010, protección ambiental-especies nativas de México de la flora y fauna silvestre- categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo, publicada.
Dutra, D.; Kane, M. and Richardson, L. 2009. Asymbiotic seed germination and in vitro seedling development of Cyrtopodium punctatum: a propagation protocol for an endangered Florida native orchid. USA. Plant Cell Tissue and Organ Culture. 96(3):235-243. 10.1007/s11240-008-9480-z.
Francisco-Nava, J. J.; Jiménez-Aparicio, A. R.; De Jesús-Sánchez, A.; Arenas-Ocampo, M. L.; Ventura-Zapata, E. y Evangelista-Lozano, S. 2011. Estudio de la morfología y aclimatación de plantas de Laelia eyermaniana Rchb. f. generadas in vitro. Polibotánica. 32(16):107-117.
Hágsater, E.; Soto-Arenas, M. Á.; Salazar-Chávez, G. A.; Jiménez-Machorro, R.; López-Rosas, M. A. y Dressler, R. L. 2005. Orquídeas de México. México. Instituto Chinoín México, DF. 304 p.
Hernández-Muñoz, S.; Pedraza-Santos, M. E.; Morales-García, J. L.; Guillén-Andrade, H.; López, P. A. and Téllez-Velasco, M. A. A. 2013. Phenotypic characterization of Mexican orchid Laelia autumnalis. Bélgica. Acta Horticulturae. 977:245-252. 10.17660/ActaHortic.2013.977.28.
Hernández-Muñoz, S.; Pedraza-Santos, M. E.; López P. A.; Cruz-Torres, E.; Martínez- Palacios, A.; Fernández-Pavía, S. P. y Chávez-Bárcenas A. T. 2017. Estimulación de la germinación y desarrollo in vitro de Laelia autumnalis con rayos gamma. México. Revista Fitotecnia Mexicana. 40(3):271-283. file:///C:/Users/IranT/Downloads/sofia,+4a%20(2).pdf.
Jara, G.; Seemann, P.; Durán, C. y Soto, S. 2007. Multiplicación in vitro y caracterización citológica de dos especies de orquídeas nativas (Chloraea y Gavilea) de la provincia de Valdivia, Chile. Agro Sur. 35(2):43-44. http://revistas.uach.cl/pdf/agrosur/v35n2/art21.pdf.
Knudson, C. 1946. A new nutrient solution for germination of orchid seed. American Orchid Society Bulletin. 15(10):214-217.
Lallana, V. H.; Billard, C. E.; Reinoso, P. D.; Martínez, V. A. y García, L. F. 2020. Banco de germoplasma de orquídeas nativas de la región litoral. Suplemento Ciencia. Docencia y Tecnología. 10(10):84-110.
Lee-Espinosa, H. E.; Laguna-Cerda, A.; Murguía-Gonzáles, J.; Iglesias-Andreu, L.; García- Rosas, B.; Escobedo-López, D.; Martínez-Ocampo, Y. M.; Barredo-Pool, F. A. y Santana-Buzzy, N. 2010. Un protocolo de embriogénesis somática para la regeneración y caracterización in vitro de Laelia anceps ssp. Dawsonii. México. Revista Fitotecnia Mexicana. 33(4):323-332. https://www.scielo.org.mx/pdf/rfm/v33n4/v33n4a10.pdf.
Lindemann, E. G. P.; Guncke, J. E. and Davidson, W. O. 1970. Meristem culture of Cattleya. American Orchid Bulletin. 39(11):1002-1004.
Martínez-Villegas, Y. M.; Andrade-Rodríguez, M.; Colinas-León, M. T.; Villegas-Torres, O. G.; Castillo-Gutiérrez, A. and Alia-Tejacal, I. 2015. Efecto de las sales inorgánicas del medio de cultivo en el crecimiento de pascuita (Euphorbia leucocephala Lotsy). Revista Fitotecnia Mexicana. 38(4):369-374.
Mayo M. A.; Cazares, J. G. C.; Cruz, E. L. y Flores, A. H. 2010. Germinación in vitro de semillas y desarrollo de plántulas de orquídeas silvestres de Tabasco. Universidad Juárez Autónoma de Tabasco. 32 p.
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. USA. Physiologia Plantarum. 15(3):473-497. Doi.org/10.1111/ j.1399-3054.1962.tb08052.x.
Solano, G. R.; Salazar, C. G. A.; Huerta, E. H.; Hágsater, E. and Jiménez, M. R. 2019. Diversity of Mexican orchids: synopsis of richness and distribution patterns. Guayaquil. Proceedings of the 22th World Orchid Conference. 255-270 pp.
SAS Institute Inc. 2023. SAS/STAT User ́s guide, Version 9,2. SAS Institute. Cary, NC.
Soto, A. M. A.; Solano, G. R. and Hágsater, E. 2007. Risk of extinction and patterns of diversity loss in Mexican orchids. Costa Rica. Lankesteriana. 7(1-2):114-121. file:///C:/users/irant/downloads/18449-Article%20Text-39767-1-10-20150311.pdf.
Verma, J.; Sharma, K.; Thakur, K.; Sembi, J. K. and Vij, S. P. 2014. Study on seed morphometry of some threatened western himalayan orchids. Turquía. Turkish Journal of Botany. 38(2):234-251. https://journals.tubitak.gov.tr/cgi/viewcontent.cgi?article=1560&context=botany.
Villaseñor, J. L. 2016. Checklist of the native vascular plants of Mexico. México. Revista Mexicana de Biodiversidad. 87(3):559-902. https://doi.org/10.1016/j.rmb.2016.06.017.
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Revista Mexicana de Ciencias Agrícolas

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Revista Mexicana de Ciencias Agrícolas accept the following conditions:
In accordance with copyright laws, Revista Mexicana de Ciencias Agrícolas recognizes and respects the authors’ moral right and ownership of property rights which will be transferred to the journal for dissemination in open access. Invariably, all the authors have to sign a letter of transfer of property rights and of originality of the article to Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) [National Institute of Forestry, Agricultural and Livestock Research]. The author(s) must pay a fee for the reception of articles before proceeding to editorial review.
All the texts published by Revista Mexicana de Ciencias Agrícolas —with no exception— are distributed under a Creative Commons License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0), which allows third parties to use the publication as long as the work’s authorship and its first publication in this journal are mentioned.
The author(s) can enter into independent and additional contractual agreements for the nonexclusive distribution of the version of the article published in Revista Mexicana de Ciencias Agrícolas (for example include it into an institutional repository or publish it in a book) as long as it is clearly and explicitly indicated that the work was published for the first time in Revista Mexicana de Ciencias Agrícolas.
For all the above, the authors shall send the Letter-transfer of Property Rights for the first publication duly filled in and signed by the author(s). This form must be sent as a PDF file to: revista_atm@yahoo.com.mx; cienciasagricola@inifap.gob.mx; remexca2017@gmail.
This work is licensed under a Creative Commons Attribution-Noncommercial 4.0 International license.


