Medios de cultivo para la germinación de semillas y crecimiento de plántulas de Laelia autumnalis
DOI:
https://doi.org/10.29312/remexca.v16i6.3811Palabras clave:
medio MS, orquídea de día de muertos, plántulas de orquídeaResumen
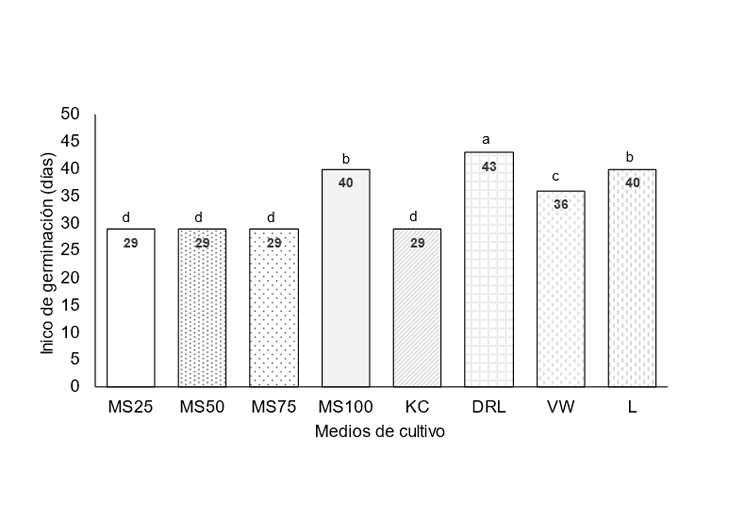
La orquídea Laelia autumnalis es endémica de México, se encuentra en protección especial. El cultivo in vitro ha contribuido a mejorar la propagación de orquídeas a partir de semillas. Con la finalidad de micropropagar esta especie, se estableció un experimento en 2023, para evaluar ocho medios de cultivo: Murashige y Skoog (MS al 100, 75, 50 y 25%), Knudson C, Dalla Rosa y Laneri, Vacint y Went y Lindemann, todos los medios se suplementaron con 0.5 mg L-1 de tiamina HCl, 100 mg L-1 de mioinositol y 3% de sacarosa, para determinar el mejor medio para la germinación de esta especie. Las semillas se desinfectaron con hipoclorito de sodio (NaClO) al 0.3% y se sembraron en los medios, en diseño completamente al azar, con 10 repeticiones por tratamiento. Se registró inicio y porcentaje de germinación, a los 90 días se evaluó altura de plántula, longitud y número de hojas, número y longitud de raíces, así como diámetro de pseudobulbos. Los medios MS al 25 y 50% generaron mayor porcentaje de germinación (84.57 y 72.54% respectivamente), la cual inició 29 días después de la siembra. El crecimiento en altura (5.6 mm), longitud de hojas (4.54 mm) y de raíces (5.2 mm) fue mayor en el medio MS al 50%, donde las plántulas fueron de color verde. Se concluyó que el mejor medio de cultivo para germinación y crecimiento de plántulas de L. autumnalis fue el MS al 50% de concentración.
Descargas
Citas
Aguilar-Morales, M. A. y López-Escamilla, A. L. 2013. Germinación in vitro de Laelia speciosa (Kunth) Schltr., una herramienta para su conservación ex situ. In: estudios científicos en el estado de Hidalgo y zonas aledañas. Pulido F. G. y Monks S. (eds.) USA. Zea Books, University of Nebraska. Volumen II. 18-24 pp. https://digitalcommons.unl.edu/hidalgo.
Ávila-Diaz, I.; Oyama, K.; Gómez-Alonzo, C. and Salgado-Garciglia, R. 2009. In vitro propagation of the endangered orchid Laelia speciosa. Plant Cell Organ Culture. 99(3):332-343. Doi:10.1007/s11240-009-9609-8.
Castillo-Pérez, L. J.; Martínez-Soto, D.; Maldonado-Miranda, J. J.; Alonso-Castro, A. J. and Carranza-Álvarez, C. 2018. The endemic orchids of Mexico: a review. Eslovaquia. Biología. 74:1-13. Doi.org/10.2478/s11756-018-0147-x.
Dalla-Rosa, M. and Laneri, U. 1977. Modification of nutrient solutions for germination and growth “in vitro” of some cultivated orchids and for the vegetative propagation of Cymbidium cultivars. American Orchid Society Bulletin. 46(9):813-820.
Dalzotto, C. A. 2013. Efecto de medios de cultivo en el crecimiento in vitro de Oncidium bifolium sims. “federal”. Revista Científica Agropecuaria. 17(1-2):7-15.
De Menezes, G. L.; Machado, M. F.; Ballesta, P.; Mora, F.; Milaneze, G. M. A. y Mangolin, C. A. 2016. Suplementos orgánicos para el cultivo in vitro del híbrido Laeliocattleya (Orchidaceae). Chile. Idesia (Arica). 34(1):47-54. https://dx.doi.org/10.4067/S0718- 34292016000100006.
DOF. 2019. Diario Oficial de la Federación. Modificación del anexo normativo III, lista de especies en riesgo de la Norma Oficial Mexicana NOM-059-SEMARNAT-2010, protección ambiental-especies nativas de México de la flora y fauna silvestre- categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo, publicada.
Dutra, D.; Kane, M. and Richardson, L. 2009. Asymbiotic seed germination and in vitro seedling development of Cyrtopodium punctatum: a propagation protocol for an endangered Florida native orchid. USA. Plant Cell Tissue and Organ Culture. 96(3):235-243. 10.1007/s11240-008-9480-z.
Francisco-Nava, J. J.; Jiménez-Aparicio, A. R.; De Jesús-Sánchez, A.; Arenas-Ocampo, M. L.; Ventura-Zapata, E. y Evangelista-Lozano, S. 2011. Estudio de la morfología y aclimatación de plantas de Laelia eyermaniana Rchb. f. generadas in vitro. Polibotánica. 32(16):107-117.
Hágsater, E.; Soto-Arenas, M. Á.; Salazar-Chávez, G. A.; Jiménez-Machorro, R.; López-Rosas, M. A. y Dressler, R. L. 2005. Orquídeas de México. México. Instituto Chinoín México, DF. 304 p.
Hernández-Muñoz, S.; Pedraza-Santos, M. E.; Morales-García, J. L.; Guillén-Andrade, H.; López, P. A. and Téllez-Velasco, M. A. A. 2013. Phenotypic characterization of Mexican orchid Laelia autumnalis. Bélgica. Acta Horticulturae. 977:245-252. 10.17660/ActaHortic.2013.977.28.
Hernández-Muñoz, S.; Pedraza-Santos, M. E.; López P. A.; Cruz-Torres, E.; Martínez- Palacios, A.; Fernández-Pavía, S. P. y Chávez-Bárcenas A. T. 2017. Estimulación de la germinación y desarrollo in vitro de Laelia autumnalis con rayos gamma. México. Revista Fitotecnia Mexicana. 40(3):271-283. file:///C:/Users/IranT/Downloads/sofia,+4a%20(2).pdf.
Jara, G.; Seemann, P.; Durán, C. y Soto, S. 2007. Multiplicación in vitro y caracterización citológica de dos especies de orquídeas nativas (Chloraea y Gavilea) de la provincia de Valdivia, Chile. Agro Sur. 35(2):43-44. http://revistas.uach.cl/pdf/agrosur/v35n2/art21.pdf.
Knudson, C. 1946. A new nutrient solution for germination of orchid seed. American Orchid Society Bulletin. 15(10):214-217.
Lallana, V. H.; Billard, C. E.; Reinoso, P. D.; Martínez, V. A. y García, L. F. 2020. Banco de germoplasma de orquídeas nativas de la región litoral. Suplemento Ciencia. Docencia y Tecnología. 10(10):84-110.
Lee-Espinosa, H. E.; Laguna-Cerda, A.; Murguía-Gonzáles, J.; Iglesias-Andreu, L.; García- Rosas, B.; Escobedo-López, D.; Martínez-Ocampo, Y. M.; Barredo-Pool, F. A. y Santana-Buzzy, N. 2010. Un protocolo de embriogénesis somática para la regeneración y caracterización in vitro de Laelia anceps ssp. Dawsonii. México. Revista Fitotecnia Mexicana. 33(4):323-332. https://www.scielo.org.mx/pdf/rfm/v33n4/v33n4a10.pdf.
Lindemann, E. G. P.; Guncke, J. E. and Davidson, W. O. 1970. Meristem culture of Cattleya. American Orchid Bulletin. 39(11):1002-1004.
Martínez-Villegas, Y. M.; Andrade-Rodríguez, M.; Colinas-León, M. T.; Villegas-Torres, O. G.; Castillo-Gutiérrez, A. and Alia-Tejacal, I. 2015. Efecto de las sales inorgánicas del medio de cultivo en el crecimiento de pascuita (Euphorbia leucocephala Lotsy). Revista Fitotecnia Mexicana. 38(4):369-374.
Mayo M. A.; Cazares, J. G. C.; Cruz, E. L. y Flores, A. H. 2010. Germinación in vitro de semillas y desarrollo de plántulas de orquídeas silvestres de Tabasco. Universidad Juárez Autónoma de Tabasco. 32 p.
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. USA. Physiologia Plantarum. 15(3):473-497. Doi.org/10.1111/ j.1399-3054.1962.tb08052.x.
Solano, G. R.; Salazar, C. G. A.; Huerta, E. H.; Hágsater, E. and Jiménez, M. R. 2019. Diversity of Mexican orchids: synopsis of richness and distribution patterns. Guayaquil. Proceedings of the 22th World Orchid Conference. 255-270 pp.
SAS Institute Inc. 2023. SAS/STAT User ́s guide, Version 9,2. SAS Institute. Cary, NC.
Soto, A. M. A.; Solano, G. R. and Hágsater, E. 2007. Risk of extinction and patterns of diversity loss in Mexican orchids. Costa Rica. Lankesteriana. 7(1-2):114-121. file:///C:/users/irant/downloads/18449-Article%20Text-39767-1-10-20150311.pdf.
Verma, J.; Sharma, K.; Thakur, K.; Sembi, J. K. and Vij, S. P. 2014. Study on seed morphometry of some threatened western himalayan orchids. Turquía. Turkish Journal of Botany. 38(2):234-251. https://journals.tubitak.gov.tr/cgi/viewcontent.cgi?article=1560&context=botany.
Villaseñor, J. L. 2016. Checklist of the native vascular plants of Mexico. México. Revista Mexicana de Biodiversidad. 87(3):559-902. https://doi.org/10.1016/j.rmb.2016.06.017.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


