Seed disinfection and culture media in the in vitro germination and growth of seedlings of Eysenhardtia polystachya (Ortega)
DOI:
https://doi.org/10.29312/remexca.v16i5.3744Keywords:
disinfection method, kidneywood, MS medium, WPM mediumAbstract
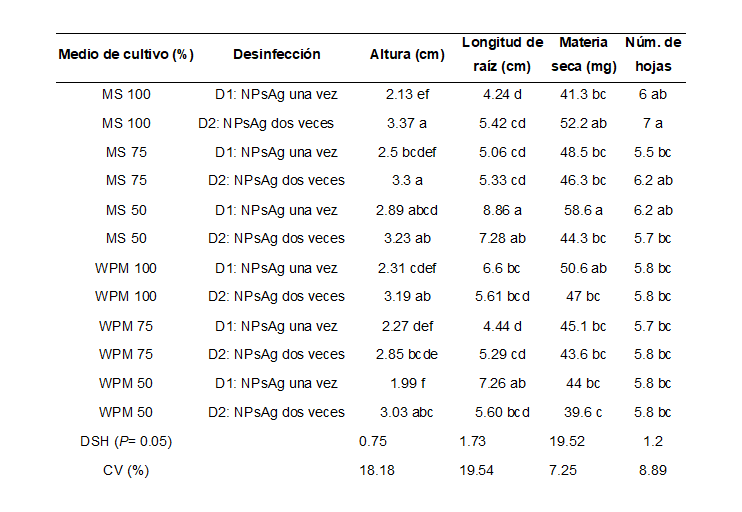
Eysenhardtia polystachya is a plant prized for the strength of its wood and medicinal use. It is propagated by seed; nevertheless, low germination and attack by insects and fungi in natural conditions limit its availability, which makes it highly vulnerable. In vitro culture allows the number of individuals to increase rapidly. The objective was to evaluate the effect of mineral salts of Murashige and Skoog and Woody Plant Medium culture media, both in concentration of 50, 75 and 100% (macro and micronutrients), in combination with two methods of seed disinfection. E. polystachya seeds collected in November 2021 in Tlayacapan Morelos were used; these were disinfected with silver nanoparticles, applied once or twice, and then seeded in vitro. The experimental design was completely randomized with factorial arrangement of treatments, with 10 replications of five seeds. Double application of silver nanoparticles generated 98.3% of aseptic seeds, compared to applying them once (86.7%). Plant height was also 34.5% higher. The MS medium generated better germination in the three concentrations (90 to 99%). Root length and dry matter were more abundant in the MS medium at 50%. It was concluded that it is convenient to use silver nanoparticles twice to disinfect E. polystachya seeds and to use the 50% MS culture medium for germination and seedling growth.
Downloads
References
Andrade-Rodríguez, M.; Vargas-Araujo, J.; Villegas-Torres, O. G.; López-Martínez, V.; Guillen-Sánchez, D. y Alia-Tejacal, I. 2015. Germinación de semillas y crecimiento de plántulas de Cattleya (Brassolaeliocattleya) in vitro. Interciencia. 40(8):549-553. https://www.interciencia.net/wp-content/uploads/2017/10/549-c-andrades5.pdf.
Bello-Bello, J. y Spinoso-Castillo, J. 2022. Utilización de nanopartículas de plata en la micropropagación de plantas. Revista Interdisciplinaria en nanociencias y nanotecnología. 16(30):1-14. https://doi.org/10.22201/ceiich.24485691e.2023.30.69692.
Beltrán-Rodríguez, L.; Manzo-Ramos, F.; Maldonado-Almanza, B.; Martínez-Ballesté, A. and Blancas, J. 2017. Wild medicinal species traded in the Balsas Basin, Mexico: risk analysis and recommendations for their conservation. Journal of Ethnobiology. 37(4):743-764. https://doi.org/10.2993/0278-0771-37.4.743.
Beltrán-Rodríguez, L.; Maldonado-Almanza, B.; Cristians, S.; Blancas, J.; Sierra-Huelz, A. y Bye, R. 2020. Las cortezas como productos forestales no maderables en México: Análisis nacional y recomendaciones para su aprovechamiento sostenible. Instituto de Biología. Universidad Nacional Autónoma de México (UNAM). Consejo Nacional de Ciencia y Tecnología. 47 p.
Bernabé-Antonio, A.; Maldonado-Magaña, A.; Ramírez-López, C. B.; Salcedo-Pérez, E.; Meza-Contreras, J. C.; González-García, Y.; López-Dellamary, T. and Cruz-Sosa, F. 2017. Establishment of callus and cell suspension cultures of Eysenhardtia polystachya (Ortega) and fungistatic activity of their extracts. South African Journal of Botany. 112:40-47. https://doi.org/10.1016/j.sajb.2017.05.023.
Bernabé-Antonio, A.; Sánchez-Sánchez, A.; Romero-Estrada, A.; Meza-Contreras, J. C.; Silva-Guzmán, J. A.; Fuentes-Talavera, F. J.; Hurtado-Díaz, I. and Cruz-Sosa, F. 2021. Establishment of a cell suspension culture of Eysenhardtia platycarpa: Phytochemical screening of extracts and evaluation of antifungal activity. Plants. 10(2):1-21. https://doi.org/10.3390/plants10020414.
Campos, R. J.; Arteaga, M. C.; Campos, S. R.; Chico, J. R. y Cerna, R. L. 2020. Establecimiento de un protocolo de desinfección y micropropagación in vitro de “caoba” Swietenia macrophylla King (Meliaceae). Arnaldoa. 27(1):141-156. http://doi.org/10.22497/arnaldoa.271.27107.
Chávez-García, J. A.; Andrade-Rodríguez, M.; Bello-Bello, J. J.; Rueda-Barrientos, M. C.; Guillén-Sánchez, D. y Sainz-Aispuro, M. J. 2020. Nanopartículas de plata en el establecimiento in vitro de ápices de gladiolo. Revista Fitotecnia Mexicana. 43(4-A):557-564. https://doi.org/10.35196/rfm.2020.4-A.557.
Gelviz-Gelvez, S. M.; Pavón, N. P.; Flores, J.; Barragán, F. y Paz, H. 2020. Germinación de siete especies de arbustos en el centro semiárido de México: efecto de la sequía y el tamaño de la semilla. Botanical Sciences. 98(3):464-472. http://doi.org/10.17129/botsci.2537.
Haida, Z.; Nakasha, J. J. and Hakiman, M. 2020. In vitro responses of plant growth factors on growth, yield, phenolics content and antioxidant activities of Clinacanthus nutans (Sabah Snake Grass). Plants. 9(8):1-17. https://doi.org/10.3390/plants9081030.
Lorenzo-Barrera, N. A.; Andrade-Rodríguez, M.; Villegas-Torres, O. G.; Román-Montes, E.; Sotelo-Nava, H.; Rodríguez-Rojas, T. J. y Suárez-Rodríguez, R. 2023. Usos del palo dulce Eysenhardtia polystachya (Ort.) Sarg., en cuatro municipios del estado de Morelos, México. Polibotánica. 55(28):161-177. http://doi.org/10.18387/polibotanica.55.11.
Lorenzo-Barrera, N. A.; Andrade-Rodríguez, M.; Villegas-Torres, O. G. and Sotelo-Nava, H. 2024. Pre-germination treatments on kidneywood (Eysenhardtia polystachya) seeds. Revista Ciência Agronômica. 55:e20238765. https://doi.org/10.5935/1806-6690.20230067.
McCown, B. H. and Lloyd, G. 1981. Woody Plant Medium (WPM)-a mineral nutrient formulation for microculture of Woody Plant Species. HortScience. 16(4):453-453.
Martín, R. M. H.; Ibarra, F. A.; Moreno, M. S.; Hernández, J. E. y Retes, R. 2021. Costo beneficio asociado con la cosecha de semilla de palo dulce y sitiporo en la región central de Sonora, México. Revista Mexicana de Agronegocios. 48(1):754-764. https://www.redalyc.org/articulo.oa?id=14167610015.
Martínez-Villegas, Y. M.; Andrade-Rodríguez, M.; Colinas-León, T.; Villegas-Torres, O. G.; Castillo-Gutiérrez, A. y Alia-Tejacal, I. 2015. Efecto de las sales inorgánicas del medio de cultivo en el crecimiento de pascuita (Euphorbia leucocephala Lotsy). Revista Fitotecnia Mexicana. 38(4):369-374. https://www.scielo.org.mx/scielo.php?pid=S0187-73802015000400004&script=sci-abstract&tlng=pt.
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco cultures. Physiology Plantarum. 15(3):473-497.
Núñez-Cruz, A.; Meave, J. A. and Bonfil, C. 2018. Reproductive phenology and seed germination in eight tree species from a seasonally dry tropical forest of Morelos, Mexico: Implications for community-oriented restoration and conservation. Tropical Conservation Science. 11(1):1-14. https://doi.org/10.1177/1940082917749946.
Pinedo-Panduro, M.; Alves-Chagas, E.; Freitas-Luz, F.; Cardoso-Chagas, P.; Panduro-Tenazoa, N. M.; Bardales-Lozano, R.; Abanto-Rodríguez, C.; Paredes-Dávila, E. y Collazos-Saldaña, H. 2022. Efecto de las sales de los medios de cultivo Murashige & Skoog y Knudson sobre el establecimiento in vitro de Epidendrum schomburgkii Lindl. Ciencia y Tecnología Agropecuaria. 23(3):2526, 1-14. https://doi.org/10.21930/rcta.vol23-num3-art:2526.
Ramírez-Mosqueda, M. A.; Sánchez‑Segura, L. and Hernández‑Valladolid, S. L. 2020. The influence of silver nanoparticles on a common contaminant isolated during the establishment of Stevia rebaudiana Bertoni culture. Plant Cell Tissue and Organ Culture. 143(3):609‑618. https://doi.org/10.1007/s11240‑020‑01945‑9.
Raya-Pérez, J. C.; Aguirre-Mancilla, C. L.; Covarrubias-Prieto, J.; Ramírez-Pimentel, G. y Iturriaga, G. 2020. El osmoacondicionamiento de las semillas agrícolas. Ciencia y Tecnología Agropecuaria. 8(1):1-8. https://www.somecta.org.mx/rev-ciencia-y-tecnol-agrop-mexico/revistas/2020-1/2020-1-1/.
SAS Institute Inc. 1995. SAS/STAT User’s guide, Version 9,2. SAS Institute. Cary, NC.
Spinoso-Castillo, J. L.; Chávez-Santoscoy, R. A.; Bogdanchikova, N.; Pérez-Sato, J. A.; Morales-Ramos, V. and Bello-Bello, J. J. 2017. Antimicrobial and hormetic effects of silver nanoparticles on in vitro regeneration of vanilla (Vanilla planifolia Jacks. ex Andrews) using a temporary immersion system. Plant Cell Tissue and Organ Culture. 129(2):195-207. https://doi.org/10.1007/s1124001711698.
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Revista Mexicana de Ciencias Agrícolas

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Revista Mexicana de Ciencias Agrícolas accept the following conditions:
In accordance with copyright laws, Revista Mexicana de Ciencias Agrícolas recognizes and respects the authors’ moral right and ownership of property rights which will be transferred to the journal for dissemination in open access. Invariably, all the authors have to sign a letter of transfer of property rights and of originality of the article to Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) [National Institute of Forestry, Agricultural and Livestock Research]. The author(s) must pay a fee for the reception of articles before proceeding to editorial review.
All the texts published by Revista Mexicana de Ciencias Agrícolas —with no exception— are distributed under a Creative Commons License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0), which allows third parties to use the publication as long as the work’s authorship and its first publication in this journal are mentioned.
The author(s) can enter into independent and additional contractual agreements for the nonexclusive distribution of the version of the article published in Revista Mexicana de Ciencias Agrícolas (for example include it into an institutional repository or publish it in a book) as long as it is clearly and explicitly indicated that the work was published for the first time in Revista Mexicana de Ciencias Agrícolas.
For all the above, the authors shall send the Letter-transfer of Property Rights for the first publication duly filled in and signed by the author(s). This form must be sent as a PDF file to: revista_atm@yahoo.com.mx; cienciasagricola@inifap.gob.mx; remexca2017@gmail.
This work is licensed under a Creative Commons Attribution-Noncommercial 4.0 International license.


