Desinfección de semillas y medios de cultivo en la germinación y crecimiento de plántulas in vitro de Eysenhardtia polystachya (Ortega)
DOI:
https://doi.org/10.29312/remexca.v16i5.3744Palabras clave:
medio MS, medio WPM, método de desinfección, palo dulceResumen
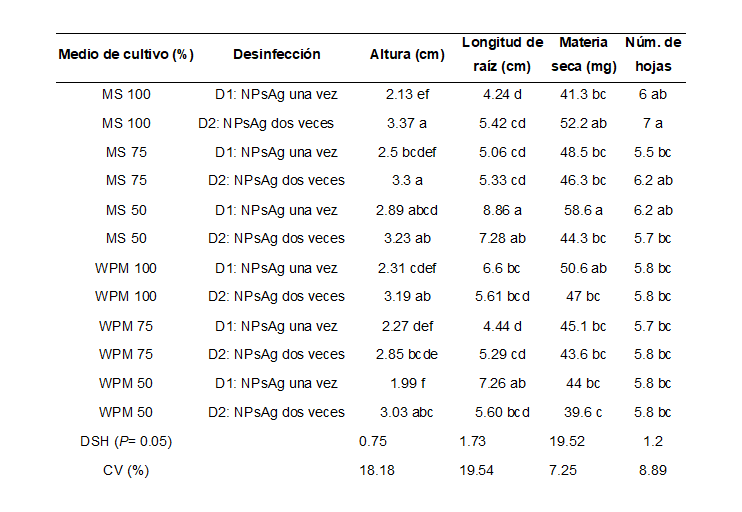
Eysenhardtia polystachya es una planta apreciada por la resistencia de la madera y uso medicinal. Se propaga por semilla; sin embargo, la baja germinación, ataque por insectos y hongos en condiciones naturales limitan su disponibilidad, lo que la hace altamente vulnerable. El cultivo in vitro permite incrementar de forma rápida el número de individuos. El objetivo fue evaluar el efecto de las sales minerales de los medios de cultivo Murashige y Skoog y Woody Plant Medium, ambos en concentración de 50, 75 y 100% (macro y micronutrientes), en combinación con dos métodos de desinfección de semillas. Se usaron semillas de E. polystachya colectadas en noviembre del 2021 en Tlayacapan Morelos, estas fueron desinfectadas con Nanopartículas de plata (NPsAg), aplicadas una o dos veces y después sembradas in vitro. El diseño experimental fue completamente al azar con arreglo factorial de tratamientos, con 10 repeticiones de cinco semillas. La doble aplicación de NPsAg generó 98.3% de semillas asépticas, en comparación con aplicarlas una vez (86.7%). También la altura de las plantas fue 34.5% mayor. El medio MS generó mejor germinación en las tres concentraciones (90 a 99%). La longitud de raíz y materia seca fueron mayores en el medio MS al 50%. Se concluyó que es conveniente usar NPsAg dos veces para desinfectar las semillas de E. polystachya y usar el medio cultivo MS al 50% para la germinación y crecimiento de plántulas.
Descargas
Citas
Andrade-Rodríguez, M.; Vargas-Araujo, J.; Villegas-Torres, O. G.; López-Martínez, V.; Guillen-Sánchez, D. y Alia-Tejacal, I. 2015. Germinación de semillas y crecimiento de plántulas de Cattleya (Brassolaeliocattleya) in vitro. Interciencia. 40(8):549-553. https://www.interciencia.net/wp-content/uploads/2017/10/549-c-andrades5.pdf.
Bello-Bello, J. y Spinoso-Castillo, J. 2022. Utilización de nanopartículas de plata en la micropropagación de plantas. Revista Interdisciplinaria en nanociencias y nanotecnología. 16(30):1-14. https://doi.org/10.22201/ceiich.24485691e.2023.30.69692.
Beltrán-Rodríguez, L.; Manzo-Ramos, F.; Maldonado-Almanza, B.; Martínez-Ballesté, A. and Blancas, J. 2017. Wild medicinal species traded in the Balsas Basin, Mexico: risk analysis and recommendations for their conservation. Journal of Ethnobiology. 37(4):743-764. https://doi.org/10.2993/0278-0771-37.4.743.
Beltrán-Rodríguez, L.; Maldonado-Almanza, B.; Cristians, S.; Blancas, J.; Sierra-Huelz, A. y Bye, R. 2020. Las cortezas como productos forestales no maderables en México: Análisis nacional y recomendaciones para su aprovechamiento sostenible. Instituto de Biología. Universidad Nacional Autónoma de México (UNAM). Consejo Nacional de Ciencia y Tecnología. 47 p.
Bernabé-Antonio, A.; Maldonado-Magaña, A.; Ramírez-López, C. B.; Salcedo-Pérez, E.; Meza-Contreras, J. C.; González-García, Y.; López-Dellamary, T. and Cruz-Sosa, F. 2017. Establishment of callus and cell suspension cultures of Eysenhardtia polystachya (Ortega) and fungistatic activity of their extracts. South African Journal of Botany. 112:40-47. https://doi.org/10.1016/j.sajb.2017.05.023.
Bernabé-Antonio, A.; Sánchez-Sánchez, A.; Romero-Estrada, A.; Meza-Contreras, J. C.; Silva-Guzmán, J. A.; Fuentes-Talavera, F. J.; Hurtado-Díaz, I. and Cruz-Sosa, F. 2021. Establishment of a cell suspension culture of Eysenhardtia platycarpa: Phytochemical screening of extracts and evaluation of antifungal activity. Plants. 10(2):1-21. https://doi.org/10.3390/plants10020414.
Campos, R. J.; Arteaga, M. C.; Campos, S. R.; Chico, J. R. y Cerna, R. L. 2020. Establecimiento de un protocolo de desinfección y micropropagación in vitro de “caoba” Swietenia macrophylla King (Meliaceae). Arnaldoa. 27(1):141-156. http://doi.org/10.22497/arnaldoa.271.27107.
Chávez-García, J. A.; Andrade-Rodríguez, M.; Bello-Bello, J. J.; Rueda-Barrientos, M. C.; Guillén-Sánchez, D. y Sainz-Aispuro, M. J. 2020. Nanopartículas de plata en el establecimiento in vitro de ápices de gladiolo. Revista Fitotecnia Mexicana. 43(4-A):557-564. https://doi.org/10.35196/rfm.2020.4-A.557.
Gelviz-Gelvez, S. M.; Pavón, N. P.; Flores, J.; Barragán, F. y Paz, H. 2020. Germinación de siete especies de arbustos en el centro semiárido de México: efecto de la sequía y el tamaño de la semilla. Botanical Sciences. 98(3):464-472. http://doi.org/10.17129/botsci.2537.
Haida, Z.; Nakasha, J. J. and Hakiman, M. 2020. In vitro responses of plant growth factors on growth, yield, phenolics content and antioxidant activities of Clinacanthus nutans (Sabah Snake Grass). Plants. 9(8):1-17. https://doi.org/10.3390/plants9081030.
Lorenzo-Barrera, N. A.; Andrade-Rodríguez, M.; Villegas-Torres, O. G.; Román-Montes, E.; Sotelo-Nava, H.; Rodríguez-Rojas, T. J. y Suárez-Rodríguez, R. 2023. Usos del palo dulce Eysenhardtia polystachya (Ort.) Sarg., en cuatro municipios del estado de Morelos, México. Polibotánica. 55(28):161-177. http://doi.org/10.18387/polibotanica.55.11.
Lorenzo-Barrera, N. A.; Andrade-Rodríguez, M.; Villegas-Torres, O. G. and Sotelo-Nava, H. 2024. Pre-germination treatments on kidneywood (Eysenhardtia polystachya) seeds. Revista Ciência Agronômica. 55:e20238765. https://doi.org/10.5935/1806-6690.20230067.
McCown, B. H. and Lloyd, G. 1981. Woody Plant Medium (WPM)-a mineral nutrient formulation for microculture of Woody Plant Species. HortScience. 16(4):453-453.
Martín, R. M. H.; Ibarra, F. A.; Moreno, M. S.; Hernández, J. E. y Retes, R. 2021. Costo beneficio asociado con la cosecha de semilla de palo dulce y sitiporo en la región central de Sonora, México. Revista Mexicana de Agronegocios. 48(1):754-764. https://www.redalyc.org/articulo.oa?id=14167610015.
Martínez-Villegas, Y. M.; Andrade-Rodríguez, M.; Colinas-León, T.; Villegas-Torres, O. G.; Castillo-Gutiérrez, A. y Alia-Tejacal, I. 2015. Efecto de las sales inorgánicas del medio de cultivo en el crecimiento de pascuita (Euphorbia leucocephala Lotsy). Revista Fitotecnia Mexicana. 38(4):369-374. https://www.scielo.org.mx/scielo.php?pid=S0187-73802015000400004&script=sci-abstract&tlng=pt.
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco cultures. Physiology Plantarum. 15(3):473-497.
Núñez-Cruz, A.; Meave, J. A. and Bonfil, C. 2018. Reproductive phenology and seed germination in eight tree species from a seasonally dry tropical forest of Morelos, Mexico: Implications for community-oriented restoration and conservation. Tropical Conservation Science. 11(1):1-14. https://doi.org/10.1177/1940082917749946.
Pinedo-Panduro, M.; Alves-Chagas, E.; Freitas-Luz, F.; Cardoso-Chagas, P.; Panduro-Tenazoa, N. M.; Bardales-Lozano, R.; Abanto-Rodríguez, C.; Paredes-Dávila, E. y Collazos-Saldaña, H. 2022. Efecto de las sales de los medios de cultivo Murashige & Skoog y Knudson sobre el establecimiento in vitro de Epidendrum schomburgkii Lindl. Ciencia y Tecnología Agropecuaria. 23(3):2526, 1-14. https://doi.org/10.21930/rcta.vol23-num3-art:2526.
Ramírez-Mosqueda, M. A.; Sánchez‑Segura, L. and Hernández‑Valladolid, S. L. 2020. The influence of silver nanoparticles on a common contaminant isolated during the establishment of Stevia rebaudiana Bertoni culture. Plant Cell Tissue and Organ Culture. 143(3):609‑618. https://doi.org/10.1007/s11240‑020‑01945‑9.
Raya-Pérez, J. C.; Aguirre-Mancilla, C. L.; Covarrubias-Prieto, J.; Ramírez-Pimentel, G. y Iturriaga, G. 2020. El osmoacondicionamiento de las semillas agrícolas. Ciencia y Tecnología Agropecuaria. 8(1):1-8. https://www.somecta.org.mx/rev-ciencia-y-tecnol-agrop-mexico/revistas/2020-1/2020-1-1/.
SAS Institute Inc. 1995. SAS/STAT User’s guide, Version 9,2. SAS Institute. Cary, NC.
Spinoso-Castillo, J. L.; Chávez-Santoscoy, R. A.; Bogdanchikova, N.; Pérez-Sato, J. A.; Morales-Ramos, V. and Bello-Bello, J. J. 2017. Antimicrobial and hormetic effects of silver nanoparticles on in vitro regeneration of vanilla (Vanilla planifolia Jacks. ex Andrews) using a temporary immersion system. Plant Cell Tissue and Organ Culture. 129(2):195-207. https://doi.org/10.1007/s1124001711698.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


