Cribado fitoquímico y efecto antibacteriano de extractos fenólicos de dos Cupressus mediterráneos
DOI:
https://doi.org/10.29312/remexca.v13i5.2473Palabras clave:
Cupressus arizonica, Cupressus sempervirens, Pseudomonas aeruginosa, extracto hidroalcohólicoResumen
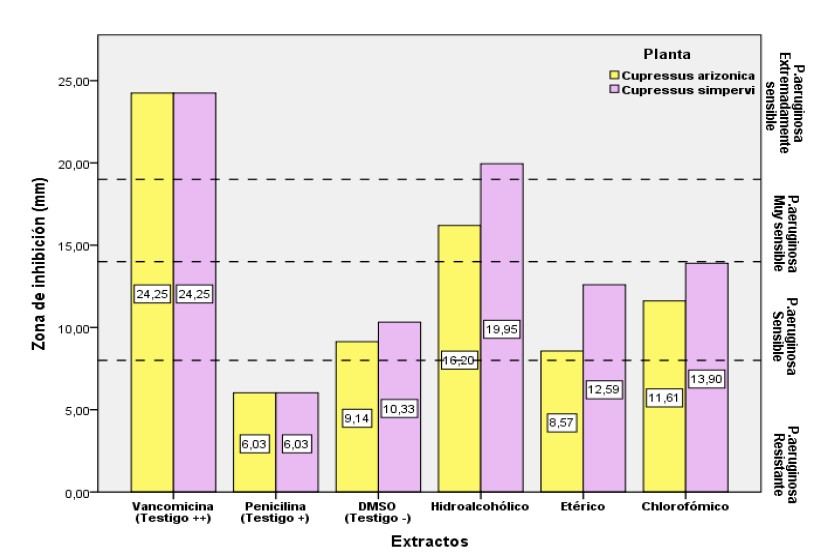
El objetivo de nuestra investigación es identificar los componentes químicos y evaluar in vitro, la actividad antibacteriana de los extractos de las hojas de Cupressus sempervirens L. y Cupressus arizonica L. del norte de Argelia contra Pseudomonas aeruginosa ATCC 9027. La extracción se realizó macerando las hojas en disolventes de polaridad creciente (cloroformo, éter de petróleo y metanol acuoso). Se realizó un cribado de los compuestos fenólicos para una caracterización cualitativa de los distintos extractos. Los extractos obtenidos se pusieron en contacto con una cepa de P. aeruginosa para determinar su potencial antibacteriano. El cribado fitoquímico reveló la presencia de varios metabolitos secundarios: leucoantocianinas, flavonoles, flavononas, antraquinonas, taninos catequicos, taninos gálicos, esteroides, triterpenos, saponina, glucósidos cardíacos, terpenoides, saponósidos y quinonas libres. El metanol acuoso (de alta polaridad) permite la extracción de la mayoría de los metabolitos. El mejor rendimiento de extracción de los tres disolventes es el cloroformo, con un rendimiento de extracción de 61.23% (C. sempervirens) y 52.27% (C. arizonica), seguido del disolvente hidroalcohólico 33.55% y etéreo con 0.39%. La extracción hidroalcohólica induce una sensibilidad muy importante de P. aeruginosa con un diámetro de 16.2 mm para C. arizonica. Extractos etéreos y clorofórmicos inducen una inhibición débil. P. aeruginosa es extremadamente sensible al extracto hidroalcohólico de C. sempervirens, este último induce una zona de inhibición con un diámetro de 19.95 mm que es estadísticamente igual a la inducida por la Vancomicina. Estos resultados pueden considerarse como una solución prometedora para la sustitución de la vancomicina por el extracto hidroalcohólico de C. sempervirens.
Descargas
Citas
Azzaz, N. A.; Hamed, S. S. and Kenawy, T. A. 2019. Chemical studies on cypress leaves (Cupressus sempervirens) and their activity as antimicrobial agents. Al-Azhar J. Agric. Res. 44(2):100-109.
Benavente-Garcia, O.; Castillo, J.; Marin, F. R.; Ortuno, A. and Del-Rio, J. A. 1997. Uses and properties of citrus flavonoids, J. Agric. Food Chem. 45(12):4505-4515. DOI: https://doi.org/10.1021/jf970373s
Bouayed, J.; Rammal, H.; Younos, C.; Dicko, A. and Soulimani, R. 2008. Caractérisation et bio évaluation des polyphénols: nouveaux domaines d’application en santé et nutrition. Springer. 4(6):71-74. DOI: https://doi.org/10.1007/s10298-008-0292-4
Bruneton, J. 1993. Les tannins. (Ed.). Médicinales internationales. Paris. 404-407 pp.
Bssaibis, F.; Gmira, N. and Meziane, M. 2009. Activité antibactérienne de Dittrichia viscosa (L). W. Greuter. Rev. Microbiol. Ind San Environ. 3:44-55. Celiktas, O.; Hames-Kocabas, E.; Bedir, E.; Sukan, F.; Ozek, T. and Baser, K. 2007. Antimicrobial activities of methanol extracts and essential oils of Rosmarinus officinalis L., depending on location and seasonal variations. Food Chem. 100(2):553-9. DOI: https://doi.org/10.1016/j.foodchem.2005.10.011
Chaitra, S.; Kumar, N.; Shalini, P.; Sindhu, R. and Raj, K. 2015. Phytochemical analysis and antibacterial activity of Albergia paniculata roxb. International journal of pharmaceutical sciences and research. 6(2):712-716.
Chaudhary, H.; Shahid, W.; Bano, A.; Ullah, F.; Munis, F.; Fahad, S. and Ahmad, I. 2012. In vitro analysis of Cupressus sempervirens L. plant extracts antibaterial activity. J. Med. Plants Res. 6(2):273-276. DOI: https://doi.org/10.5897/JMPR11.1246
Debib, A.; Tir-touil, A.; Mothana, R.; Meddah, B. and Sonnet, P. 2014. Phenolic content, antioxidant and antimicrobial activities of two fruit varieties of Algerian Ficus carica L. J. Food Bio. 38(2):207-215. DOI: https://doi.org/10.1111/jfbc.12039
Djahra, A. 2014. Etude phytochimique et activité antimicrobienne, antioxydante, antihépatotoxique du Marrube blanc ou Marrubium vulgare L. Universite badji mokhtar annaba. Thèse de doctorat. 114-120 pp.
Evans, W. C. 1996. Phytochemical screening. In: Trease GE, Evans WC, (Ed). Textbook of pharmacognosy. London: tindal limited. 541-548.
Falleh, H.; Ksouri, R.; Chaieb, K.; Karray-Bouraoui, N.; Trabelsi, N.; Boulaaba, M. and Abdelly, C. 2008. Phenolic composition of Cynara cardunculus L. organs, and their biological activities. Compt. Rend. Biol. 331(5):372-379. DOI: https://doi.org/10.1016/j.crvi.2008.02.008
Farhat, A.; Ginies, C.; Romdhane, M. and Chemat, F. 2009. Eco-friendly and cleaner process for isolation of essential oil using microwave energy: experimental and theoretical study. J. Chromatogr. A. 1216(26):5077-5085. DOI: https://doi.org/10.1016/j.chroma.2009.04.084
Graglia, E.; Julkunen-Tïito, R. and Shaver, G. 1996. Environmental control and intersite variations of phenolics in Betuna nana in tundra ecosystems. New Phytologist. 151(1):227-236. DOI: https://doi.org/10.1046/j.1469-8137.2001.00149.x
Harborne, A. J. 1998. Phytochemical methods a guide to modern techniques of plant analysis, 3 ème (Ed.). Springer, Netherlands. 302-311.
Harborne, J. B. 1973. Phytochemical methods. London chapman and hall, Ltd. 49-56 pp.
Hayouni, E. A.; Abedrabba, M.; Bouix, M. and Hamdi, M. 2007. The effects of solvents and extraction method on the phenolic contents and biological activities in vitro of Tunisian (Quercus coccifera L.) and (Juniperus phoenicea L.) fruit extracts. Food Chem. 105(3):1126-34. DOI: https://doi.org/10.1016/j.foodchem.2007.02.010
Hiermann, A.; Schramm, H. W. and Laufer, S. 1998. Antiinflammatory activity of myricitin-3-o-beta-D-glucuronide and related compounds. Inflamm. 47(11):421-427. DOI: https://doi.org/10.1007/s000110050355
Hodek, P.; Trefil, P. and Stiborov, A. M. 2002. Flavonoids-potent and versatile biologically active compounds interacting with cytochromes P450. Chem. Biol. Interact. 139(1):1-21. DOI: https://doi.org/10.1016/S0009-2797(01)00285-X
Kanwal, Q.; Hussain, I.; Latif-Siddiqui, H. and Javaid, A.2010. Antifungal activity of flavonoids isolated from mango (Mangifera indica L.) leaves. Nat. Prod. Res. 24(20):1907-14. DOI: https://doi.org/10.1080/14786419.2010.488628
Lakhdar, L. 2015. Evaluation de l’activite antibactérienne d’huiles essentielles marocaines sur Aggregatibacter actinomycetemcomitans: étude in vitro. Université mohammed v rabat. Maroc. Thése de doctotrat. 183 p.
Liu, C. M.; Zhou, H. B. and Zhang, W. D. 2010. Terpenoids from stems and leaves of Cupressus gigantea. Chin. J. Nat. Med. 8(6):0405-0410. DOI: https://doi.org/10.1016/S1875-5364(11)60002-2
Lozniewski, A. and Rabaud, C. 2010. Résistance bactérienne aux antibiotiques, Fiches conseils pour la prévention du risque infectieux-Infections associées aux soins, CCLIN, Sud-Est, Nancy. 4- 6 pp.
Macheix, J. J.; Fleuriet, A. and Jay-Allemand, C. 2005. Les composées phénoliques des végétaux. France. (Ed.). Presses Polytechniques. 192 p.
Ngameni, B.; Kuete, V.; Simo, I. K.; Mbaveng, A. T.; Awoussong, P. K.; Patnam, R.; Roy, R. and Ngadjui, B. T. 2009. Antibacterial and antifungal activities of the crude extract and compounds from Dorstenia turbinata (Moraceae). S. Afr. J. Bot. 75(2):256-61. DOI: https://doi.org/10.1016/j.sajb.2008.11.006
Nostro, N.; Germano, M.; Ángelo, V. D. and Cannatelli, M. 2000. Extraction methods and bioautography for evaluation of medicinal plant antimicrobial activity. Letters Appl. Microbiol. 30(5):379-384. DOI: https://doi.org/10.1046/j.1472-765x.2000.00731.x
Ponce, A. G.; Fritz, R.; Del-Valle, C. and Roura, S. I. 2003. Antimicrobial activity of essential oils on the native microflora of organic swiss chard. Lwt-Food Sci Technol. 36(7):679-84. DOI: https://doi.org/10.1016/S0023-6438(03)00088-4
Quezel, P. and Santa, S.1963. Nouvelle flore de l’Algérie. Tome I. centre national de la recherche scientifique. Paris, France. 34-35 pp.
Ribéreau-Gayon, P. 1968. Les composés phénoliques des végétaux. (Ed.). Dunod, Paris. 232-242 pp.
Romani, A.; Pinelli, P.; Cantini, C.; Cimato, A. and Heimler, D. 2006. Characterization of Violetto di Toscana, a typical Italian variety of artichoke (Cynara scolymus L). J. Food Chem. 95(2):221-225. DOI: https://doi.org/10.1016/j.foodchem.2005.01.013
Scalbert, A. 2004. Fruits et légumes, polyphénols et santé, laboratoires des maladies métaboliques et micronutritions, INRA, Centre de recherche de clermont-ferrand/theix. 198-203 pp.
Selim, S. A.; Adam, M. E.; Hassan, S. M. and Albalawi, A. R. 2014. Chemical composition, antimicrobial and antibiofilm activity of the essential oil and (Cupressus sempervirens L.). BMC complementary and alternative medicine. 14(179):1-8. DOI: https://doi.org/10.1186/1472-6882-14-179
Shunying, Z.; Yang, Y.; Huaidong, Y.; Yue, Y. and Guolin, Z. 2005. Chemical composition and antibacterial activity of the essential oils of Chrysanthemum indicum. J. Ethnopharmacol. 96(2):151-158. DOI: https://doi.org/10.1016/j.jep.2004.08.031
Trease, G. E. and Evans, W. C. 1989. Pharmacognosy. 27. 13th (Ed.). London: ELBS/Bailliere Tindall, London. 345-772 pp.
Trease, G. E. and Evans, W. C. 2002. Pharmacognosy. 15th (Ed.). Saunders. 214-393 pp.
Zimmer, N. and Cordesse, R. 1996. Influence des tannins sur la valeur nutritive des aliments des ruminants. INRA. Prod Anim. 9(3):167-179.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2022 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


