Mejora de la germinación del trébol bajo estrés metálico mediante la inoculación con Bradyrhizobium sp. (Lotus)
DOI:
https://doi.org/10.29312/remexca.v16i4.3658Palabras clave:
cadmio, cobre, fisiología, PGPRResumen
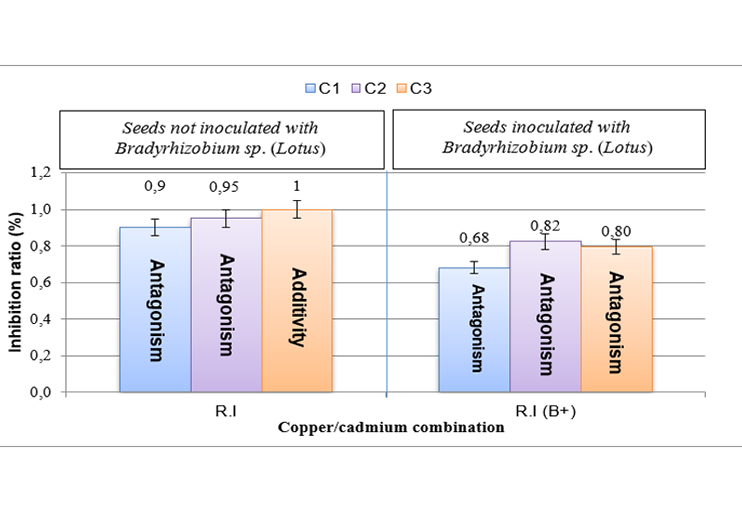
Este estudio investiga el efecto de la inoculación con Bradyrhizobium sp. (Lotus), una rizobacteria simbiótica, en la germinación del trébol bajo estrés inducido por cobre, cadmio y su combinación. El objetivo es destacar el papel de Bradyrhizobium sp. (Lotus) en la mitigación del estrés por cobre y cadmio y mejorar la germinación del trébol, una especie espontánea de interés forrajero. La investigación, realizada en Blida (Argelia) en 2024, se centra en los aspectos fisiológicos de la germinación, incluido el conteo total de germinación, el tiempo medio de germinación y la inhibición de la reversibilidad de la germinación. El análisis estadístico se realizó mediante Manova con un umbral del 5%. Los resultados indican que la inoculación con Bradyrhizobium sp. (Lotus) aumenta los valores de conteo total de germinación y reduce la fase de retardo de la germinación de +168 h a 48 h. Además, la inhibición de la germinación se reduce en un 20 a 30% en comparación con las semillas no inoculadas y los parámetros fisiológicos de germinación mejoran bajo condiciones de estrés por metal. Los hallazgos sugieren que Bradyrhizobium sp. (Lotus) puede mitigar el estrés por cobre y cadmio mediante la detoxificación o quelación, mejorando así la tolerancia del trébol a estos elementos traza metálicos durante la etapa de germinación.
Descargas
Citas
Ashraf, M. and Foolad, M. R. 2007. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Journal of Experimental Botany. 59(2):206-216.
Barassi, C. A.; Ayrault, G.; Creus, C. M.; Sueldo, R. J. and Sobrero, M. T. 2006. Seed inoculation with Azospirillum mitigates NaCl effects on lettuce. Scientia Horticulturae. 109(1):8-14.
Bennani, K. and Bendaou, N. 2015. Influence de la salinité en plein champ sur la teneur en phytoestrogènes et la germination d’écotypes marocains de Trifolium. Canadian Journal of Plant Science. 95(3):461-466.
Brockwell, J.; Pilka, A. and Holliday, R. A. 2005. Soil restoration through the introduction of legumes in degraded land. Plant and Soil. 270(1-2):251-264.
Come, D. 1970. Obstacles to germination. Ed. Masson et Cie. 162 p.
Croteau, M. N.; Luoma, S. N. and Stewart, A. R. 2005. Trophic transfer of metals along freshwater food webs: Evidence of cadmium biomagnification in nature. Limnology and Oceanography. 50(5):1511-1319.
De-Forest, D. K.; Brix, K. V. and Adams, W. J. 2007. Assessing metal bioaccumulation in aquatic environments: the inverse relationship between bioaccumulation factors, trophic transfer factors and exposure concentration. Aquatic Toxicology. 84(2):236-246.
Degaichia, H.; Boussahoua, A. R. and Bakria, T. 2024. Resistance of Bradyrhizobium sp. (Lotus) to metallic stress. Agropastoralis Scientia. 1(2):73-83.
Ernst, W. H. O. 1998. Effects of heavy metals in plants at the cellular and organismic level ecotoxicology. In: Gerrit, S. & Bernd, M. Ed. Bioaccumulation and biological effects of chemicals, John Wiley & Sons and Spektrum Akademischer Verlag. 587-620 pp.
Fernandes, J. C. and Henriques, F. S. 1991. Biochemical, physiological and structural effects of excess copper in plants. Botanical Review. 57(1):246-273.
Mihoub, A.; Chaoui, A. and Ferjani, E. 2005. Biochemical changes induced by cadmium and copper during germination of pea seeds (Pisum sativum L.). Comptes Rendus Biologies. 328 p.
Mills, A. L. and Colwell, R. R. 1977. Microbiological effects of metal ions in Chesapeake Bay and sediments. Bulletin of Environmental Contamination and Toxicology. 18(1):99-103.
Nelson, L. M. 2004. Plant growth promoting rhizobacteria (PGPR): prospects for new inoculants. Crop Management. 3(1):1-7.
Osborne, J. M.; Fox, J. E. D. and Mercer, S. 1993. Germination response under elevated salinities of six semi-arid blue bush species (Western Australia). In: Lieth, H. & Masoom, A. Al. Ed. Towards the rational use of high salinity plants. 323-338. pp
Silini, A.; Cherif-Silini, H. and Yahiaoui, B. 2016. Growing varieties durum wheat (Triticum durum) in response to the effect of osmolytes and inoculation by Azotobacter chroococcum under salt stress. African Journal of Microbiology Research. 10(12):387-399.
Smýkal, P.; Vernoud, V.; Blair, M. W.; Soukup, A. and Thompson, R. D. 2015. The role of the legume Lotus spp. in sustainable agriculture and ecological restoration. Critical Reviews in Plant Sciences. 34(1-3):43-80.
Somasegaran, P. and Hoben, H. J. 1994. Handbook for rhizobia. Springer Verlag New York Inc. 450 p.
Vincent, J. M. 1970. A manual for the practical study of the root-nodule bacteria. IBP Handbook No. 15. Blackwell Scientific Publishers. 154 p.
Woolhouse, H. W. 1983. Toxicity and tolerance in the responses of plants to metals. In O. L. Lange, P. S. Nobel, C. B. Osmond, & H. Ziegler Ed. Encyclopaedia of Plant Physiology, New Series 12C. Springer-Verlag. 245-300 pp.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


