Degradación de almidón de reserva de la semilla de Phaseolus vulgaris L. silvestre y domesticado
DOI:
https://doi.org/10.29312/remexca.v16i3.3602Palabras clave:
azúcares reductores, frijol, germinación, sustancia de reservaResumen
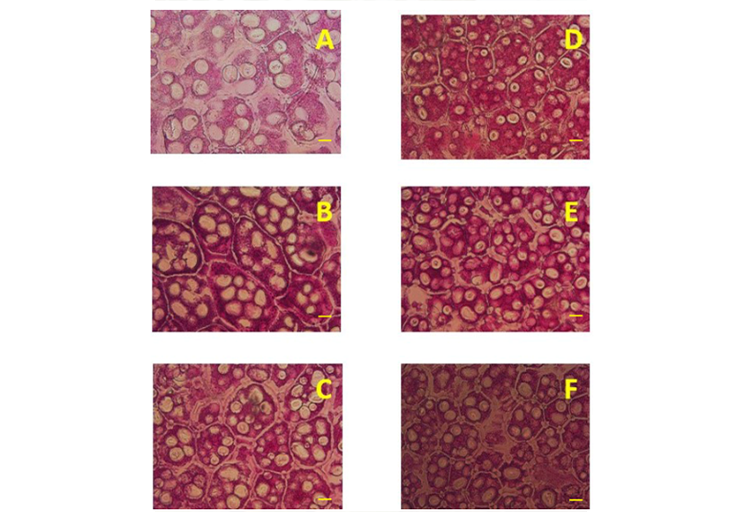
La domesticación ha modificado el tamaño y el tipo de reservas de las semillas, de aquí surge la pregunta si esas modificaciones han tenido impacto en el metabolismo y la movilización de esas reservas durante la germinación y establecimiento de las plántulas. El objetivo de la investigación fue determinar el efecto de la domesticación en cotiledones, eje embrional y plántulas desarrolladas en oscuridad de frijoles domesticados y silvestres. En 2019, ocho semillas de tres variedades mejoradas y tres recolectas silvestres se germinaron a 25 °C, otras ocho semillas con radícula expuesta se sembraron en bolsas de cultivo y las plántulas obtenidas se mantuvieron por 14 días en oscuridad. Las semillas germinadas y las plántulas se disectaron en sus estructuras y se determinó su masa seca, la concentración de almidón, glucosa, fructosa y sacarosa y además en cotiledones, el número de células, y el número de los gránulos de almidón mm-2 y las dimensiones de estos. Se utilizó un diseño completamente al azar con cuatro repeticiones. Las variedades mejoradas en promedio tuvieron 11 y tres veces más materia seca en cotiledones y eje embrional comparadas con las silvestres, y siete, nueve y 13 más en raíz, vástago y remanente de cotiledones, respectivamente. Concentraciones de almidón, glucosa y sacarosa por gramo de masa seca fueron mayores en cotiledones de las mejoradas; en contraste, concentraciones de almidón, glucosa y fructosa fueron mayores en el eje embrional de las silvestres. En raíz, las silvestres tuvieron más concentración de almidón, fructosa y sacarosa, y en vástago, los domesticados más glucosa, fructosa y sacarosa. Las silvestres tuvieron 42% más células y 30% más gránulos de almidón que las domesticadas por unidad de superficie. La domesticación modifica la composición y movilización de reservas durante la germinación y establecimiento de plántulas.
Descargas
Citas
Allaby, R. G. 2020. Domestication syndrome in plants. In: Encyclopedia of Global Archeology. Smith, C. Ed. Springer. New York. 2182-2184 pp. Doi.org/10.1007/978-3-030-30018-0-2416.
Allende-Arrarás, G.; Acero-Godínez, M. G.; Padilla-Ramírez, J. S.; Mayek-Pérez, N. 2006. Comportamiento agronómico y características fisicoquímicas del grano de frijol en Aguascalientes, México. Revista Fitotecnia Mexicana. 29(1):89-93.
Ansari, O.; Chogazardi, H. R.; Sharifzadeh, F. and Nazarli, H. 2012. Seed reserve utilization and seedling growth of treated seeds of mountain rye (Secale montanum) as affected by drought stress. Cercetari Agronomice in Moldova. 45(2):43-48. https://repository.iuls.ro/xmlui/handle/20.500.12811/2297.
Bajaj, R.; Singh, N.; Kaur, A. and Inouchi, N. 2018. Structural, morphological, functional and digestibility properties of starches from cereals, tubers and legumes: comparative study. Journal of food Science and Technology. 55(9):3799-3808. https://doi.org/10.1007/s13197-018-3342-4.
Bewley, J. D.; Bradford, K. J. H.; Henk, W. M.; Nonogaki, H. 2013. Seeds: physiology of development and germination. Springer Science+Business Media LLC. New York. 444 p.
Carbonero, P.; Iglesias-Fernández, R. and Carbajosa, J. V. 2017. The AFL subfamily of B3 transcription factors: evolution and function in angiosperm seeds. Journal of Experimental Botany. 68(4):871-880. Doi:10.1093/jxb/erw458.
Celis-Velázquez, R.; Peña-Valdivia, C. B.; Trejo-López, C.; Aguirre-Rivera, J.R.: Córdova-Téllez, L. and Carballo-Carballo, A. 2008. Consumo de reservas de la semilla de frijol para la emergencia y desarrollo inicial en diferentes profundidades de siembra. Agronomía Mesoamericana. 19(2):167-177. https://www.redalyc.org/pdf/437/43711425002.pdf.
Cilia-García, M.; Peña-Valdivia, C. B.; Bernal Gracida, L. A.; Yáñez Jiménez, P.; García Esteva A. and Padilla-Chacón, D. 2021. Effects of water restriction on carbohydrates concentration, starch granules size and amylolytic activity in seeds of Phaseolus vulgaris L. and P. acutifolius A. Gray. Botanical Sciences. 99(2):364-376. Doi.org/10.17129/botsci.26476.
Coelho, C. M. M. and Benedito, V. A. 2008. Seed development and reserve compound accumulation in common bean (Phaseolus vulgaris L.). Seed Science Biotechnology. 2(2):42-52.
Di Vittori, V.; Gioia, T.; Rodríguez, M.; Bellucci, E.; Bitochi, E.; Nanni, M.; Attene, G.; Rou, D. and Papa, R. 2019. Convergent evolution of the seed shattering trait. Genes. 10(1):68. Doi:10.3390/genes10010068. 16 p.
Estrada-Gómez, J. A.; Estrada-Trejo, V.; Hernández-Livera, A.; Molina-Moreno, J. C. and Campos-Escudero, A. 2004. OTI una nueva variedad de frijol para el Valle de México. Revista Fitotecnia Mexicana. 27(1):115-116.
Golan, G.; Oksenberg, A. and Peleg, Z. 2015. Genetic evidence for differential selection of grain and embryo weight during wheat evolution under domestication. Journal of Experimental Botany. 66(19):5703-5711. https://doi.org/10.1093/jxb/erv249.
Hu, X. W.; Zhang, R.; Wu, Y. P. and Baskin, C. C. 2017. Seedling tolerance to cotyledon removal varies with seed size: a case of five legume species. Ecology and Evolution. 7(15):5948-5955. Doi.org/10.1002/ece3.3169.
Johansen, D. A. 1940. Plant microtechnique. McGraw Hill Book Company, Inc. London. 530 p.
Lastdrager, J.; Hanson, J. and Smeekens, S. 2014. Sugars signals and the control of plant growth and development. Journal of Experimental Botany. 65(3):799-807. Doi:10.1093/jxb/ert474.
Lépiz-Ildefonso, R.; López-Alcocer, J. J.; Sánchez-González, J. J.; Santacruz-Ruvalcaba, F.; Nuño-Romero, R. y Rodríguez-Guzmán, E. 2010. Características morfológicas de formas cultivadas, silvestres o intermedias de frijol común de hábito trepador. Revista Fitotecnia Mexicana. 33(1):21-28.
Milla, R. and Matesanz, S. 2017. Growing larger with domestication: a matter of physiology, morphology or allocation? Plant Biology. 19(3):475-483. https://doi.org/10.1111/plb.12545.
Mohammadi, H.; Soltani, A.; Sadeghipour, H. R. and Zeinaly, E. 2011. Effects of seed aging on subsequent seed reserve utilization and seedling growth in soybean. International Journal of Plant Production. 5(1):65-70.
Morales-Santos, M. E.; Peña-Valdivia, C. B.; García-Esteva, A.; Aguilar-Benítez, G. and Kohashi-Shibata, J. 2017. Características físicas y de germinación en semillas y plántulas de frijol (Phaseolus vulgaris L.) silvestre, domesticado y su progenie. Agrociencia. 51(1):43-62. https://www.scielo.org.mx/pdf/agro/v51n1/1405-3195-agro-51-01-00043-en.pdf.
Ortega-Delgado, M. L. y Rodríguez-Coquíez, C. 1979. Estudio de carbohidratos en variedades mexicanas de frijol (Phaseolus vulgaris L. y Phaseolus coccineus L.). Agrociencia. 37:33-49.
Pandey, R.; Vijay, P. and Dadlani, M. 2010. Mobilization of seed reserves and environmental control of seed germination. In: Seed Science and Technology. Singhal, N.C. Ed. Kalyani Publishers. New Deli, India. 84-116 pp.
Pritchard, S. L.; Charlton, W. L.; Baker, A. and Graham, I. A. 2002. Germination and storage reserve mobilization are regulated independently in Arabidopsis. The Plant Journal. 31(5):39-647. https://onlinelibrary.wiley.com/doi/pdf/10.1046/j.1365-313X.2002.01376.x.
Punia, S.; Dhull, S. B.; Sandhu, K. S.; Kaur, M. and Purewal, S. S. 2020. Kidney bean (Phaseolus vulgaris) starch: A review. Legume Science. 2(3):e52. https://doi.org/10.1002/ leg3.52.
Roucou, A.; Violle, C.; Fort, F.; Roumet, P.; Ecarnot, M. and Vile, D. 2018. Shifts in plant functional strategies over the course of wheat domestication. Journal Applied Ecology. 55:25-37. Doi.org/10.1111/1365-2664.13029.
Sánchez-Linares, L.; Gavilanes-Ruíz, M.; Díaz-Pontones, D.; Guzmán-Chávez, F.; Calzada-Alejo, V.; Zurita-Villegas, V.; Luna-Loaiza, V.; Moreno-Sánchez, R.; Bernal-Lugo, I. and Sánchez-Nieto, S. 2012. Early carbon mobilization and radicle protrusion in maize germination. Journal of Experimental Botany. 63(12):4513-4526. https://doi.org/10.1093/jxb/ers130.
SAS Institute Inc. 2012. SAS version 9.3. Cary, N.C., USA.
Schneider, A.; Aghamirzaie, D.; Elmarakeby, H.; Poudel, A. N.; Koo, A. J.; Heath, L. S.; Grene, R. and Collakova, E. 2016. Potential targets of viviparous 1/abi 3‐like 1 (val 1) repression in developing Arabidopsis thaliana embryos. The Plant Journal. 85(2):305-319.
Shi, J. and Lai, J. 2015. Patterns of genomics change with crop domestication and breeding. Current Opinion in Plant Biology. 24:47-53. Doi.org/10.1016/j.pbi.2015.01.008.
Shi, J. and Lai, J. 2015. Patterns of genomics change with crop domestication and breeding. Current Opinion in Plant Biology. 24:47-53. https://doi.org/10.1016/j.pbi.2015.01.008.
SigmaPlot Version 14. 2019. Systat Software, Inc., San Jose, California.
Singh, S. P.; Gepts, P. and Debouck, D. G. 1991. Races of common bean (Phaseolus vulgaris, Fabaceae). Economic Botany. 45(3):379-396.
Smýkal, P.; Nelson, M. N.; Berger, J. D. and Von Wettberg, E. J. B. 2018. The impact of genetic changes during crop domestication. Agronomy. 8(7):119-141. Doi.org/10.3390/agronomy8070119.
Vargas-Vázquez, M. L. P.; Uscanga-Mortera, E.; Padilla-Chacón, D.; Vibrans, H.; Kohashi-Shibata, J.; Miranda-Colín, S. y Yáñez-Jiménez, P. 2020. Asignación de biomasa y carbohidratos en semillas y plántulas de Phaseolus coccineus L. domesticado y silvestre. Botanical Sciences. 98(2):366-376. Doi: 10.17129/botsci.2485.
Viola, R. and Davies, H. V. 1992. A microplate reader assay for rapid enzymatic quantification of sugars in potato tubers. Potato Research. 35:55-58. https://link.springer.com/content/pdf/10.1007/BF02357723.pdf.
Wani, I. A.; Sogi, D. S.; Wani, A. A.; Gill, B. S. and Shivhare, U. S. 2010. Physico‐chemical properties of starches from Indian kidney bean (Phaseolus vulgaris) cultivars. International Journal of Food Science & Technology. 45(10):2176-2185. http://dx.doi.org/10.1111/j.1365-2621.2010.02379.x.
Yamaguchi, J. 1978. Respiration and growth efficiency in relation to crop productivity. Journal of the Faculty of Agriculture, Hokkaido Univ. 59(1):59-129. https://eprints.lib.hokudai.ac.jp/dspace/handle/2115/12920.
Yoshida, H.; Nozaki, K.; Hanashiro, I.; Yagi, F.; Ito, H.; Honma, M.; Matsui, H. and Takeda, Y. 2003. Structure and physicochemical properties of starches from kidney bean seeds at immature, premature and mature stages of development. Carbohydrate Research. 338(5):463-469. Doi.org/10.1016/S0008-6215(02)00489-5.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


