Antagonistic microorganisms as management of Fusarium oxysporum wilt of blackberry
DOI:
https://doi.org/10.29312/remexca.v15i3.3655Keywords:
Rubus, Fusarium, biocontrol, comprehensive management, wiltAbstract
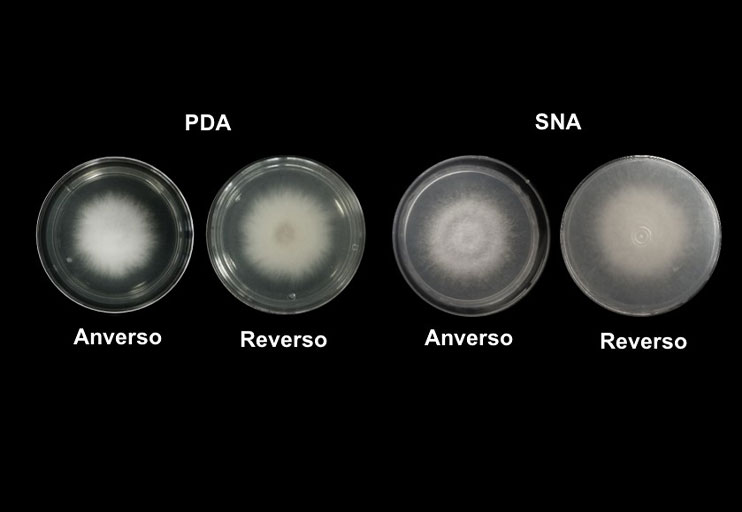
In the states of Michoacán, Mexico and California, USA, blackberry (Rubus sp.) production is affected by wilt, which causes the loss of thousands of hectares. In the present work, the causative agent of the disease was identified and control alternatives with antagonistic microorganisms were proposed. In 2022, the causative agent of the disease was isolated and morphologically identified from an orchard in Tocumbo, Michoacán. A preliminary laboratory bioassay was performed with strains of B. subtilis, B. amyloliquefaciens, P. fluorescens, and Trichoderma spp., native to Tacámbaro and Taretan, Mich. The outstanding strains were tested in a greenhouse on plants of blackberry cv Tupy as a preventive measure and as a control, under an experimental design of randomized blocks with six repetitions. In the preliminary tests, all the strains used showed an inhibition of the mycelial growth of the pathogen greater than 50%, with Trichoderma sp. from Tacámbaro, B. subtilis and P. fluorescens standing out. In the tests carried out in situ, preventively applied treatments decreased the incidence of wilt by 57% to 66%. In terms of severity and plant height, Trichoderma sp. stood out, while the percentage of root necrosis decreased by 56% to 70% with all treatments. Control treatments also showed antagonistic efficacy, although to a lesser extent, they decreased the incidence of wilt by 2 to 58% and the percentages of root necrosis by 19 to 62%. Antagonistic microorganisms can be incorporated as a comprehensive management strategy with high efficiency.
Downloads
References
Acosta-González, U.; Hernández-Castrejón, J.; Rebollar-Alviter, A.; Silva-Rojas, H. V.; Romero-Bautista, A. y González-Villegas, R. 2018. Effect of chemical, biological fungicides, and plant resistance inducers for the management of blackberry wilt caused by Fusarium oxysporum. Conference: International congress of plant pathology, Boston, MA. Doi:10.13140/RG.2.2.12995.04646.
Agrios, G. N. 2005. Plant pathology. Fifth edition. Ed. Elsevier. USA. 635 p.
Barnett, H. L and Hunter, B. B. 1998. Illustrated genera of imperfect fungi. 4th Ed. Burgess Publishing Company Minneapolis, Minnesota USA. 218 p.
Bhattacharyya, P. N. and Jha, D. K. 2011. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World Journal of Microbiology and Biotechnology. 28(4):1327-1350.
Boughalleb-M’Hamdi, N.; Salem, I. B. and M’Hamdi, M. 2018. Evaluation of the efficiency of Trichoderma, Penicillium and Aspergillus species as biological control agents against four soil-borne fungi of melon and watermelon. Egyptian Journal of Biological Pest Control. 28(1):25-36.
Bouziane, Z.; Dehimet, L. and Kacem Chaouch N. 2016. Inhibitory activity of Trichoderma viride against Phytophthora infestans that affects the Spunta potato (Solanum tuberosum L.) variety. African Journal of Microbiology Research. 10(29):1121-1127.
Cano, M. A. 2011. Interacción de microorganismos benéficos en plantas: micorrizas, Trichoderma spp. y Pseudomonas spp. una revisión. Revista U.D.C.A Actualidad y divulgación científica. 14(2):15-31.
Contreras-Cornejo, H. A.; Macías-Rodríguez, L.; Del-Val, E. and Larsen, J. 2016. Ecological functions of Trichoderma spp. and their secondary metabolites in the rhizosphere: interactions with plants. FEMS Microbiology Ecology. 92(4):1-21.
Cornelis, P.; Baysse, C. and Matthijs, S. 2008. Iron uptake in Pseudomonas. In Pseudomonas: genomics and molecular biology. Brussel, Belgium. Ed. Cornelis, P. Caister Academic Press. 213-235 pp.
Dhingra, O. D. and Sinclair, J. B. 1985. Basic plant pathology methods. CRC Press, Inc. Boca Raton, Florida. 355 p.
Gómez, R, H.; Soberanis, R. W.; Tenorio, C, M. y Torres, A. E. 2013. Manual de producción y uso de hongos antagonistas. Servicio Nacional de Sanidad Agraria. 6-7 pp.
Gordon, T. R.; Kong, M.; Broome, J. C.; Pastrana, A. M. and Kirkpatrick, S. C. 2017. Fusarium oxysporum f. sp. mori, a new forma specialist causing Fusarium wilt of Blackberry. Plant Diesease. 101(12):2066-2072.
Guédez, C.; Cañizalez, L.; Castillo, C. y Olivar, R. 2009. Efecto antagónico de Trichoderma harzianum sobre algunos hongos patógenos postcosecha de la fresa (Fragaria spp.). Revista de la Sociedad Venezolana de Microbiología. 29(1):34-38.
Guédez, C.; Cañizalez, L.; Castillo, C. y Olivar, R. 2012. Evaluación in vitro de aislamientos de Trichoderma harzianum para el control de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum en plantas de tomate. Revista de la Sociedad Venezolana de Microbiología. 32(1):44-49.
Guédez, C.; Castillo, C.; Cañizalez, L. y Olivar, R. 2008. Control biológico: una herramienta para el desarrollo sustentable y sostenible. Academia. 3(13):50-74.
Guerra, G. A.; Betancourth, C. A. y Salazar, C. E. 2011. Antagonismo de Pseudomonas fluorescens Migula frente a Fusarium oxysporum fsp. pisi Schtdl en Arveja Pisum sativum L. Revista UDCA actualidad & divulgación científica. 14(2):33-42.
Hernández-Cruz, A.; Saldivia-Tejeda, A.; Silva-Rojas, H. V.; Fuentes-Aragón, D.; Nava-Díaz, C.; Martínez-Bolaños, L. and Rebollar-Alviter, A. 2020. Evaluation of full-season programs for the management of Fusarium wilt of blackberry caused by a new lineage of the Fusarium oxysporum species complex. Crop Protection. 134(2020):4-11.
Infante, D.; Martínez, B.; González, N. y Reyes, Y. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Revista Protección Vegetal. 24(1):14-21.
Leslie, J. F. and Summerell, B. A. 2006. The Fusarium laboratory manual. Ed. Blackwell Publishing. First edition. Iowa, USA. 5-30(119):212-218.
Martinez, B.; Infante, D. y Reyes, Y. 2013. Trichoderma spp. y su función en el control de plagas en los cultivos. Revista Protección Vegetal. 28(1):1-11.
Mayo, S.; Gutiérrez, S.; Malmierca, M. G.; Lorenzana, A.; Campelo, M. P.; Hermosa, R. and Casquero, P. A. 2015. Influence of Rhizoctonia solani and Trichoderma spp. in growth of bean (Phaseolus vulgaris L.) and in the induction of plant defense-related genes. Frontiers in Plant Science. 6(685):1-11.
Mejía-Bautista, M. A.; Cristóbal-Alejo, J.; Tun-Suárez, J. M. y Reyes-Ramírez, A. 2016. Actividad in vitro de Bacillus spp. en la inhibición de crecimiento micelial de Fusarium equiseti y Fusarium solani aislado de chile habanero (Capsicum chinense Jacq.). Agrociencia. 50(8):1123-1135.
Perotti, E. B. R.; Menéndez, L. T.; Gaia, O. E. y Pidello, A. 2005. Supervivencia de Pseudomonas fluorescens en suelos con diferente contenido de materia orgánica. Revista Argentina de Microbiología. 37(2):102-105.
Rebollar, A. A. y Silva, R. H. V. 2019. La marchitez de la zarzamora. Diagnóstico, epidemiología y manejo integrado. Universidad Autónoma de Chapingo (UACH). 1ra. Ed. México. 10-16 pp.
Ricárdez-Luna, G.; Aguilar-Rivera, N.; Galindo-Tovar, M. E. y Debernardi-Vázquez, T. J. 2016. Diagnóstico de la producción de zarzamora (Rubus sp.) en la zona centro de Veracruz, México. Agroproductividad. 9(6):34-38.
Ruiz-Cisneros, M. F.; Ornelas-Paz, J. J.; Olivas-Orozco, G. I.; Acosta-Muñiz, C. H.; Sepúlveda-Ahumada, D. R.; Pérez-Corral, D. A. y Ríos-Velasco, C. 2018. Efecto de Trichoderma spp. y hongos fitopatógenos sobre el crecimiento vegetal y calidad del fruto de jitomate. Revista Mexicana de Fitopatología. 36(3):444-456.
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/.
RStudio Team. 2020. Studio: integrated development for R. RStudio, PBC, Boston, MA. http://www.rstudio.com/.
SIAP. 2021. Servicio de Información Agropecuaria y Pesquera. Anuario estadístico de la producción agrícola. Cierre de la producción agrícola. https://nube.siap.gob.mx/cierreagricola/.
Singh, J. S. and Singh, D. P. 2013. Plant growth promoting rhizobacteria (PGPR): microbes in sustainable agriculture. Management of Microbial Resources in the Environment. 361-385 pp.
Susan, V. R. y Castiel, A. F. 2005. Control biológico de plagas y enfermedades de los cultivos. En: Biotecnología y medioambiente. Ed. Ephemera. Madrid. 215-230 pp.
Tejera-Hernández, B.; Rojas-Badía, M. M. y Heydrich-Pérez, M. 2011. Potencialidades del género Bacillus en la promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. CENIC Ciencias Biológicas. 42(3):131-138.
Tian, L.; Shi, S.; Ji, L.; Nasir, F.; Ma, L. and Tian, C. 2018. Effect of the biocontrol bacterium Bacillus amyloliquefasciens on the rhizosphere in ginseng plantings. International Microbiology. 21(3):153-162.
Trigiano, N. R.; Windham, T. M. and Windham, S. A. 2004. Plant pathology, concepts, and laboratory excercises. CRC Press. 413 p.
Vásquez-Ramírez, L. M. y Castaño-Zapata, J. 2017. Manejo integrado de la marchitez vascular del tomate Fusarium oxysporum f. sp. lycopersici (SACC.) W. C. Snyder & H. N. Hansen: una revisión. Revista UDCA. Actualidad & Divulgación Científica. 20(2):363-374.
Villa, P. M.; Frías, A. y González, G. 2005. Evaluación de cepas de Pseudomonas sp para el control de hongos fitopatógenos que afectan cultivos de interés económico. ICIDCA Sobre los derivados de la caña de azúcar. 39(3):40-44.
Published
How to Cite
Issue
Section
License
Copyright (c) 2024 Revista Mexicana de Ciencias Agrícolas

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Revista Mexicana de Ciencias Agrícolas accept the following conditions:
In accordance with copyright laws, Revista Mexicana de Ciencias Agrícolas recognizes and respects the authors’ moral right and ownership of property rights which will be transferred to the journal for dissemination in open access. Invariably, all the authors have to sign a letter of transfer of property rights and of originality of the article to Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) [National Institute of Forestry, Agricultural and Livestock Research]. The author(s) must pay a fee for the reception of articles before proceeding to editorial review.
All the texts published by Revista Mexicana de Ciencias Agrícolas —with no exception— are distributed under a Creative Commons License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0), which allows third parties to use the publication as long as the work’s authorship and its first publication in this journal are mentioned.
The author(s) can enter into independent and additional contractual agreements for the nonexclusive distribution of the version of the article published in Revista Mexicana de Ciencias Agrícolas (for example include it into an institutional repository or publish it in a book) as long as it is clearly and explicitly indicated that the work was published for the first time in Revista Mexicana de Ciencias Agrícolas.
For all the above, the authors shall send the Letter-transfer of Property Rights for the first publication duly filled in and signed by the author(s). This form must be sent as a PDF file to: revista_atm@yahoo.com.mx; cienciasagricola@inifap.gob.mx; remexca2017@gmail.
This work is licensed under a Creative Commons Attribution-Noncommercial 4.0 International license.


