Estudio sobre la producción de proteasas de Aspergillus niger utilizando suero de leche
DOI:
https://doi.org/10.29312/remexca.v16i30.4047Palabras clave:
enzimas, fermentación, proteasa, péptidos, proteínasResumen
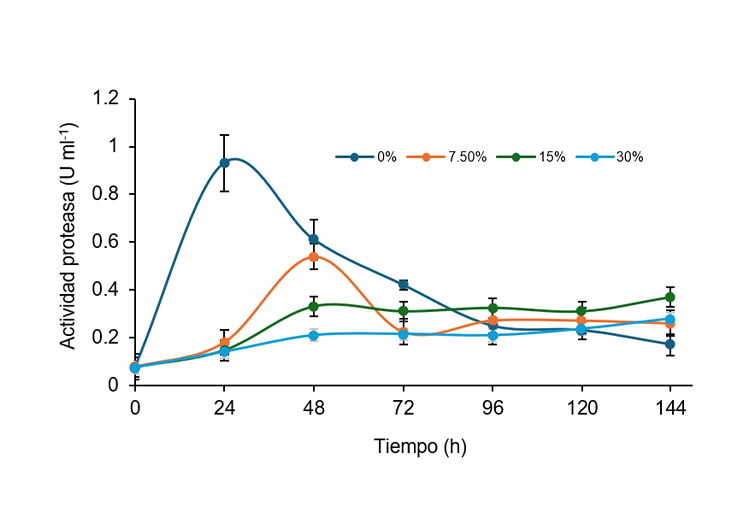
El suero de leche es un producto secundario o de deshecho de la industria láctea y generalmente de poca utilidad, con un gran contenido de proteínas que pueden inducir la síntesis fúngica de enzimas proteolíticas. El objetivo de este estudio fue evaluar la producción sustentable de enzimas proteolíticas de Aspergillus niger utilizando suero de leche como sustrato en fermentación líquida. La fermentación se realizó en matraces con 50 ml de medio de cultivo de suero de leche y concentraciones de glucosa, en el Laboratorio de Fermentaciones y Biomoléculas durante el año 2024. La fermentación se llevó a cabo a 30 °C con agitación orbital a 150 rpm durante 48 h. A los extractos de fermentación se les analizaron contenido de péptidos y actividad proteasa. Los resultados mostraron que el extracto enzimático sin glucosa agregada produjo la mayor actividad de proteasa después de 24 h. El uso de este extracto a pH 3.5 resultó en una mayor liberación de péptidos del suero. El suero al ser un sustrato complejo que contiene azúcares, proteínas, grasas y minerales, puede influir en el crecimiento de microorganismos y la producción de enzimas. La valorización de este residuo agroindustrial proporciona un método eficaz y sustentable para producir biomoléculas de uso agroalimentario y agroindustrial.
Descargas
Citas
AOAC. 1980. Official Methods of Analysis. Association of Official Analytical.
Benítez-Torre, A.; Pérez-Ramírez, E.; Morales-García, Y. E.; Muñoz-Rojas, J.; Díaz-Ruíz, R. y Morales-Almora, P. 2023. Efecto del uso de lactosuero dulce en el riego de alfalfa y maíz. Revista Mexicana de Ciencias Agrícolas. 14(29):1-12. https://doi.org/10.29312/remexca.v14i29.3532.
Boscaini, S.; Cabrera-Rubio, R.; Nychyk, O.; Speakman, J. R.; Cryan, J. F.; Cotter, P. D. and Nilaweera, K. N. 2020. Physiological Reports. 8(15):1-19. https://doi.org/10.14814/phy2.14523.
Cairns, T. C.; Nai, D. O. and Meyer, V. 2018. Cómo un hongo influye en la biotecnología: 100 años de investigación sobre Aspergillus niger. Biología y biotecnología de los hongos. 5(13):1-14. https://doi.org/10.1186/s40694-018-0054-5.
Cho, K.; Lee, J.; Han, G.; Kim, N. K.; Bae, H. and Hwang, S. 2015. Resource recovery using whey permeate to cultivate Phellinus linteus mycelium: Solid-state and submerged liquid fermentation. Journal of Dairy Science. 98(10):6739-6748. https://doi.org/10.3168/jds.2015-9631.
Crament, T. C.; Arendsen, K.; Rose, S. H. and Jansen, T. 2024. Cultivation of recombinant Aspergillus niger strains on dairy whey as a carbohydrate source. Journal of Industrial Microbiology and Biotechnology. 9(51):1-7. Doi:10.1093/jimb/kuae007.
Cen-Li; Jingwen-Zhou; Guocheng-Du; Jian-Chen; Shunji-Takahashi and Song-Liu. 2020. Developing Aspergillus niger as a cell factory for food enzyme production. Biotechnology Advances. 44:1-17. https://doi.org/10.1016/j.biotechadv.2020.107630.
Dinika, I. and Utama, G. L. 2019. Cheese Whey is a potential resource for antimicrobial edible film and active packing production. Foods and Raw Materials. 7(2):229-239. http://doi.org/10.21603/2308-4057-2019-2-229-239.
DuBois, M.; Gilles, K. A.; Hamilton, J. K.; Robers, P. A. and Smith, F. 1956. Colorimetric method for the determination of sugars and related substances. Analytical Biochemistry. 28(3):350-356. Doi: 10.1021/ac60111a017.
Fernández-Gutiérrez, D.; Veillette, M. and Giroir-Fendler, A. 2017. Biovalorization of saccharides derived from industrial wastes such as whey: a review. Reviews in Environmental Science Biotechnology. 16(1):147-174. https://doi.org/10.1007/s11157-016-9417-7.
Gill, H. S.; Doull, F.; Rutherfurd, K. J. and Cross, M. L. 2000. Immunoregulatory peptides in bovine milk. British Journal of Nutrition. 84(S1):111-117. https://doi.org/10.1017/s0007114500002336.
Irazoqui, J. M.; Santiago, G. M.; Mainez, M. E.; Amadio, A. F. and Eberhardt, M. F. 2024. Enzymes for production of whey protein hydrolysates and other value-added products. Applied Microbiology and Biotechnology. 108(1):1-11. https://doi.org/10.1007/s00253-024-13117-2.
John, J. A. and Ghosh, B. C. 2021. Production of whey protein hydrolyzates and its incorporation into milk. Food Production Processing and Nutrition. 3(1):1-13. https://doi.org/10.1186/s43014-021-00055-z.
Johnvesly, B.; Manjunath, B. and Naik, G. R. 2002. Pigeon pea waste as a novel, inexpensive, substrate for production of a thermostable alkaline from a thermoalkalophilic Bacillus sp. JB-99. Bioresource Technology. 82(1):61-64. https://doi.org/10.1016/S0960-8524(01)00147-X.
Kashung, P. and Karuthapandian, D. 2025. Milk-derived bioactive peptides. Food Production Processing and Nutrition. 7(1):1-19. https://doi.org/10.1186/s43014-024-00280-2.
Kunitz, M. 1947. Crystalline soybean tripsin inhibitor: ii. General properties. Journal of general physiology. 30(4):291-310. https://doi.org/10.1085/jgp.30.4.291.
Lam, F.; Khan, T. M.; Faidah, H.; Haseeb, A. and Khan, A. H. 2019. Effectiveness of whey protein supplements on the serum levels of amino acid, creatinine kinase and myoglobin of athletes: a systematic review and meta-analysis. Systematic Reviews. 8(1):1-12. https://doi.org/10.1186/s13643-019-1039-z.
Li, W.; Wang, J.; Zhang, J.; Takada, S. and Wang, W. 2019. Overcoming the Bottleneck of the enzymatic cycle by steric frustration. Physical Review Letters. 122(23):1-6. https://doi.org/10.1103/physrevlett.122.238102.
Li, J.; Chroumpi, T.; Garrigues, S.; Kun, R. S.; Meng, J.; Salazar-Cerezo, S.; Aguilar-Pontes, M. V.; Zhang, Y.; Tejomurthula, S.; Lipzen, A.; Ng, V.; Clendinen, C. S.; Tolić, N.; Grigoriev, I. V.; Tsang, A.; Mäkelä, M. R.; Snel, B.; Peng, M. and Vries, R. P. 2022. The sugar metabolic model of Aspergillus niger can only be reliably transferred to fungi of its phylum. Journal of Fungi. 8(12):1-23. https://doi.org/10.3390/jof8121315.
Liu, X.; Lian, M.; Zhao, M. and Huang, M. 2024. Advances in recombinant protease production: current state and perspectives. World Journal of Microbiology and Biotechnology. 40(5):144. https://doi.org/10.1007/s11274-024-03957-5.
Mordor Intelligence. 2025. Protease market size and share analysis growth trends and forecasts source. https://www.mordorintelligence.com/industry-reports/proteases-market.
Norma Oficial Mexicana. 2012. NOM-155-SCFI-2012, Leche denominaciones, especificaciones fisicoquímicas, información comercial y métodos de prueba, secretaria de economía. Estados Unidos Mexicanos. http://sidof.segob.gob.mx/notas/5254842.
Naveed, M.; Nadeem, F.; Mehmood, T.; Bilal, M.; Anwar, Z. and Amjad, F. 2021. Protease a versatile and ecofriendly biocatalyst with multi-industrial applications: an updated review. Catalysis Letters. 151(2):307-323. https://doi.org/10.1007/s10562-020-03316-7.
Nouri, N.; Sadeghi, L. and Marefat, A. 2024. Production of alkaline protease by Aspergillus niger in a new combinational paper waste culture medium. Journal of bioscience and bioengineering. 137(3):173-178. https://doi:10.1016/j.jbiosc.2023.12.010.
Quintieri, L.; Luparelli, A.; Caputo, L.; Schirinzi, W.; Bellis, F.; Smiriglia, L. and Monaci, L. 2025. Unraveling the biological properties of whey peptides and their role as emerging therapeutics in immune tolerance. Nutrients. 17(6):1-29. https://doi.org/10.3390/nu17060938.
Rojas, M. P. G. and Martinez, O. M. M. 2023. Whey protein fermentation with Aspergillus niger: source of antioxidant peptides. En Mehdi Razzaghi-Abyaneh, Mahendra Rai y Masoomeh Shams-Ghahfarokhi (Eds.). Aspergillus and aspergillosis - Advances in genomics, drug development, diagnosis and treatment. (IntechOpen, 1st ed, 208 p.). https://doi.org/10.5772/intechopen.111895.
Siala, R.; Frikha, F.; Mhamdi, S.; Nasri, M. and Kamoun, A. S. 2012. Optimization of acid protease production by Aspergillus niger I1 on shrimp peptone using statistical experimental design. The Scientific World Journal. 1-11 pp. https://doi.org/10.1100/2012/564932.
Tang, C.; Xi, T.; Zheng, J. and Cui, X. 2025. Chemical properties of whey protein in protein powders and its impact on muscle growth in athletes: a review. Natural Product Communications. 20(3):1-7. https://doi.org/10.1177/1934578x251326124.
Wang, R.; He, S. and Xuan, Y. 2020. Preparation and characterization of whey protein hydrolysate-Zn complexes. Food Measure. 14:254-261. https://doi.org/10.1007/s11694-019-00287-1.
Yin, X.; Fu, X.; Cheng, H. and Wusigale-Liang, L. 2020. α-Tocopherol and naringenin in whey protein isolate particles: partition, antioxidant activity, stability and bioaccessibility. Food Hydrocolloids. 106:105895. https://doi.org/10.1016/j.foodhyd.2020.105895.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


