Pseudomonas spp. be néficas e n la a gricultura
DOI:
https://doi.org/10.29312/remexca.v13i4.2799Palabras clave:
biocontrol, biofertilizantes, microorganismos benéficos, suelos supresivosResumen
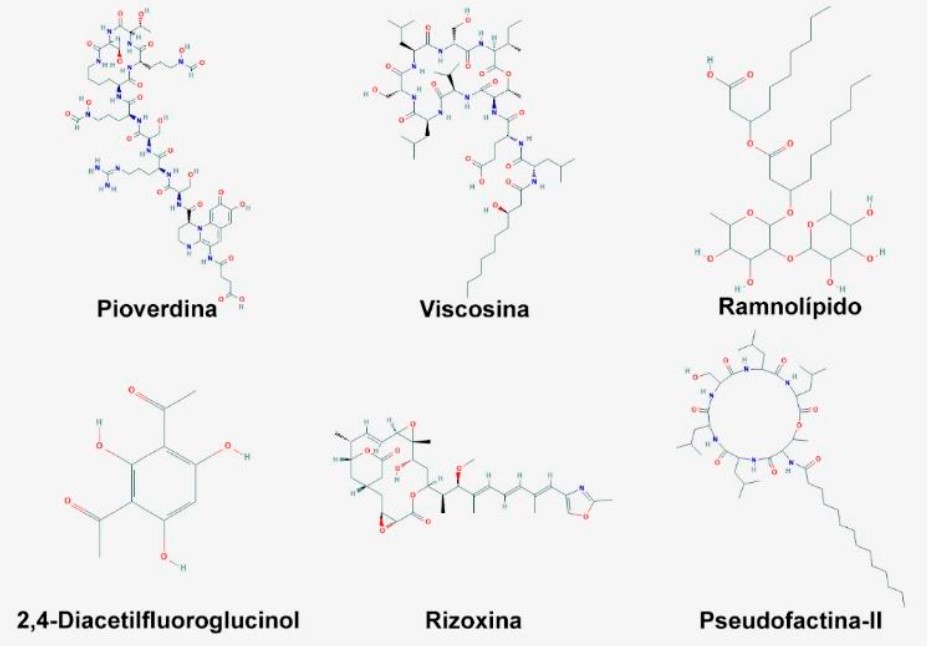
Las bacterias del género Pseudomonas habitan una amplia variedad de ambientes, lo cual es reflejo de su diversa capacidad metabólica, esto les ha permitido adaptarse a condiciones variables del ambiente, así mismo, dicho género se considera ambivalente, debido a que algunas especies establecen relaciones benéficas con las plantas y otras patogénicas con plantas, animales y humanos. En el presente trabajo nos enfocamos en el impacto positivo que este género bacteriano tiene en el ámbito agrícola, debido a su capacidad como bacteria promotora del crecimiento vegetal (BPCV), siendo una de las mejores opciones como inoculante de plantas y suelos, para mejorar el crecimiento vegetal y el manejo de sus enfermedades, mediante la amplia gama de metabolitos que son capaces de producir las cepas benéficas, se han identificado bacterias de este género con capacidad diazotrófica, productoras de antibióticos, auxinas, sideróforos, enzimas celulolíticas, ácidos orgánicos para la solubilización de fósforo y promoción de la resistencia sistémica inducida contra fitopatógenos, lo cual las hace idóneas en la producción agrícola ya sea para el biocontrol o la biofertilización, así mismo, su uso no afecta al ambiente ni la salud de los agricultores.
Descargas
Citas
Aiyar, P.; Schaeme, D.; García-Altares, M.; Flores, D. C.; Dathe, H.; Hertweck, C. and Mittag, M. 2017. Antagonistic bacteria disrupt calcium homeostasis and immobilize algal cells. Nature Comm. 8(1):1-13. https://doi.org/10.1038/s41467-017-01547-8. DOI: https://doi.org/10.1038/s41467-017-01547-8
Baker, K. F. and CooK, R. J. 1991. Biological control of plant pathogens. San Francisco: W/H Freeman & Co. Millington, S. 28-29 pp.
Biessy, A. and Filion, M. 2018. Phenazines in plant‐beneficial Pseudomonas spp.: biosynthesis, regulation, function, and genomics. Environ Microbiol. 20(11):3905-3917. https://doi.org/ 10.1111/1462-2920.14395.
Bender, C. L.; Rangaswamy, V. and Loper, J. 1999. Polyketide production by plant-associated pseudomonads. Annual Review Phytopathol. 37(1):175-196. https://doi.org/10.1146/ annurev.phyto.37.1.175. DOI: https://doi.org/10.1146/annurev.phyto.37.1.175
Chin‐A‐Woeng, T. F.; Bloemberg, G. V. and Lugtenberg, B. J. 2003. Phenazines and their role in biocontrol by Pseudomonas bacteria. New Phytologist. 157(3):503-523. https://doi.org/10. 1046/j.1469-8137.2003.00686.x DOI: https://doi.org/10.1046/j.1469-8137.2003.00686.x
Geudens, N. and Martins, J. C. 2018. Cyclic lipodepsipeptides from Pseudomonas spp.-biological swiss-army knives. Frontiers Microbiol. 9:1867. https://doi.org/10.3389/fmicb. 2018.01867.
Gross, H. and Loper, J. E. 2009. Genomics of secondary metabolite production by Pseudomonas spp. Natural Product Reports. 26(11):1408-1446. https://doi.org/10.1039/b817075b. DOI: https://doi.org/10.1039/b817075b
Gutiérrez-García, K.; Neira-González, A.; Pérez-Gutiérrez, R. M.; Granados-Ramírez, G.; Zarraga, R., Wrobel, K. and Flores-Cotera, L. B. 2017. Phylogenomics of 2-4. Diacetylphloroglucinol-producing pseudomonas and novel antiglycation endophytes from piper Auritum. J. Natur. Produc. 80(7):1955-1963. https://doi.org/10.1021/acs.jnatprod. 6b00823. DOI: https://doi.org/10.1021/acs.jnatprod.6b00823
Guttenberger, N.; Blankenfeldt, W. and Breinbauer, R. 2017. Recent developments in the isolation, biological function, biosynthesis, and synthesis of phenazine natural products. Bioo. Med. Chem. 25(22):6149-6166. https://doi.org/10.1016/j.bmc.2017.01.002. DOI: https://doi.org/10.1016/j.bmc.2017.01.002
Haas, D. and Keel, C. 2003. Regulation of antibiotic production in root colonizing Pseudomonas spp. and relevance for biological control of plant disease. Annu. Rev. Phytopathol. 41(1):117-153. https://doi.org/10.1146/annurev.phyto.41.052002.095656. DOI: https://doi.org/10.1146/annurev.phyto.41.052002.095656
Jara, H. A. D. y Elizondo E. A. M. 2011. Suelos supresivos a enfermedades radicales: ‘declinación del mal de pie (Gaeumannomyces graminis var. tritici) en trigo’, un estudio de caso. Agro Sur. 39(2):67-78. https://doi.org/10.4206/agrosur.2011.v39n2-01. DOI: https://doi.org/10.4206/agrosur.2011.v39n2-01
Jang, J. Y.; Yang, S. Y.; Kim, Y. C.; Lee, C. W.; Park, M. S.; Kim, J. C. and Kim, I. S. 2013. Identification of orfamide A as an insecticidal metabolite produced by pseudomonas protegens F6. J. Agric. Food Chem. 61(28):6786-6791. https://doi.org/10.1021/jf401218w. DOI: https://doi.org/10.1021/jf401218w
Julian, W. T.; Vasilchenko, A. V.; Shpindyuk, D. D.; Poshvina, D. V. and Vasilchenko, A. S. 2021. Bacterial-derived plant protection metabolite 2, 4-diacetylphloroglucinol: effects on bacterial cells at inhibitory and subinhibitory concentrations. Biomolecules. 11(1):13. https://doi.org/10.3390/biom11010013.
Kankariya, R. A.; Chaudhari, A. B.; Gavit, P. M. and Dandi, N. D. 2019. 2-4. Diacetylphloroglucinol: a novel biotech bioactive compound for agriculture. In microbial interventions in agriculture and environment. Springer, Singapore. 419-452 pp. https://doi.org/10.1007/978-981-13-8391-5-16.
Keswani, C.; Singh, H. B.; García-Estrada, C.; Caradus, J.; He, Y. W.; Mezaache-Aichour, S. and Sansinenea, E. 2020. Antimicrobial secondary metabolites from agriculturally important bacteria as next-generation pesticides. Appl. Microbiol. Biotechnol. 104(3):1013-1034. https://doi.org/10.1007/s00253-019-10300-8.
Keel, C.; Oberhansli, T.; Wirthner, P.; Voisard, C.; Haas, D. and Défago, G. 1990. Pseudomonads as antagonists of plant pathogens in the rhizosphere: role of the antibiotic 2-4, diacetylphloroglucinol in the suppression of black root rot of tobacco. Symbiosis.
Kumar, A.; Verma, H.; Singh, V. K.; Singh, P. P.; Singh, S. K.; Ansari, W. A. and Pandey, K. D. 2017. Role of Pseudomonas sp. in sustainable agriculture and disease management. In: agriculturally important microbes for sustainable agriculture. Springer, Singapore. 195-215 pp. https://doi.org/10.1007/978-981-10-5343-6-7. DOI: https://doi.org/10.1007/978-981-10-5343-6_7
Khan, H.; Parmar, N. and Kahlon, R. S. 2016. Pseudomonas-plant interactions I: plant growth promotion and defense-mediated mechanisms. In: Pseudomonas: molecular and applied biology. Springer, Cham. 419-468 pp. https://doi.org/10.1007/978-3-319-31198-2-10. DOI: https://doi.org/10.1007/978-3-319-31198-2_10
Kwak, Y. S.; Han, S.; Thomashow, L. S.; Rice, J. T.; Paulitz, T. C.; Kim, D. and Weller, D. M. 2011. Saccharomyces cerevisiae genome-wide mutant screen for sensitivity to 2, 4-diacetylphloroglucinol, an antibiotic produced by Pseudomonas fluorescens. Appl. Environ. Microbiol. 77(5):1770-1776. https://doi.org/10.1128/aem.02151-10. DOI: https://doi.org/10.1128/AEM.02151-10
Lambowitz, A. M. and Slayman, C. W. 1972. Effect of pyrrolnitrin on electron transport and oxidative phosphorylation in mitochondria isolated from Neurospora crassa. J. Bacteriol. 112(2):1020-1022. https://doi.org/10.1128/jb.112.2.1020-1022.1972.
Ligon, J. M.; Hill, D. S.; Hammer, P. E.; Torkewitz, N. R.; Hofmann, D.; Kempf, H. J. and Pée, K. H. V. 2000. Natural products with antifungal activity from Pseudomonas biocontrol bacteria. Pest Management Science: formerly Pesticide Science. 56(8):688-695. https://doi.org/10.1533/9781845698416.4.179. DOI: https://doi.org/10.1002/1526-4998(200008)56:8<688::AID-PS186>3.0.CO;2-V
Loper, J. E.; Henkels, M. D.; Rangel, L. I.; Olcott, M. H.; Walker, F. L.; Bond, K. L. and Taylor, B. J. 2016. Rhizoxin analogs, orfamide A and chitinase production contribute to the toxicity of Pseudomonas protegens strain Pf‐5 to Drosophila melanogaster. Environ. Microbiol. 18(10):3509-3521. https://doi.org/10.1111/1462-2920.13369. DOI: https://doi.org/10.1111/1462-2920.13369
Lugtenberg, B. J. J.; De Weger, L. A. and Schippers, B. 1994. Bacterization to protect seed and rhizosphere against disease. BCPC Monograph. 57:293-302.
Lugtenberg, B. J.; Kravchenko, L. V. and Simons, M. 1999. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1(5):439-446. https://doi.org/10.1046/j.1462-2920.1999. 00054.x. DOI: https://doi.org/10.1046/j.1462-2920.1999.00054.x
Ma, Z.; Geudens, N.; Kieu, N. P.; Sinnaeve, D.; Ongena, M.; Martins, J. C. and Höfte, M. 2016. Biosynthesis, chemical structure, and structure-activity relationship of orfamide lipopeptides produced by Pseudomonas protegens and related species. Frontiers Microbiol. 7:382. https://doi.org/10.3389/fmicb.2016.00382. DOI: https://doi.org/10.3389/fmicb.2016.00382
Ma, Z.; Ongena, M. and Höfte, M. 2017. The cyclic lipopeptide orfamide induces systemic resistance in rice to Cochliobolus miyabeanus but not to Magnaporthe oryzae. Plant Cell Reports. 36(11):1731-1746. https://doi.org/10.1007/s00299-017-2187-z. DOI: https://doi.org/10.1007/s00299-017-2187-z
Malviya, D.; Sahu, P. K.; Singh, U. B.; Paul, S.; Gupta, A.; Gupta, A. R. and Brahmaprakash, G. P. 2020. Lesson from Ecotoxicity: revisiting the microbial lipopeptides for the management of emerging diseases for crop protection. Inter. J. Environ. Res. Public Health. 17(4):1434. https://doi.org/10.3390/ijerph17041434.
Mavrodi, D. V.; Blankenfeldt, W. and Thomashow, L. S. 2006. Phenazine compounds in fluorescent Pseudomonas spp. biosynthesis and regulation. Annu. Rev. Phytopathol. 44(1):417-445. https://doi.org/10.1146/annurev.phyto.44.013106.145710. DOI: https://doi.org/10.1146/annurev.phyto.44.013106.145710
National Center for Biotechnology Information. 2021. PubChem Compound. https://pubchem.ncbi.nlm.nih.gov/.
Neiendam, N. M. and Sørensen, J. 1999. Chitinolytic activity of Pseudomonas fluorescens isolates from barley and sugar beet rhizosphere. FEMS Microbiol. Ecol. 30(3):217-227. https://doi.org/10.1111/j.1574-6941.1999.tb00650.x. DOI: https://doi.org/10.1111/j.1574-6941.1999.tb00650.x
Nose, M. and Arima, K. 1969. On the mode of action of a new antifungal antibiotic, pyrrolnitrin. The J. Antibi. 22(4):135-143. https://doi.org/10.7164/antibiotics.22.135. DOI: https://doi.org/10.7164/antibiotics.22.135
Pawar, S.; Chaudhari, A.; Prabha, R.; Shukla, R. and Singh, D. P. 2019. Microbial pyrrolnitrin: natural metabolite with immense practical utility. Biomolecules. 9(9):443. https://doi.org/10.3390/biom9090443.
Pierson, L. S. and Thomashow, L. S. 1992. Cloning and heterologous expression of the phenazine biosynthetic. Mol. Plant-Microbe Interact. 5(4):330-339. https://doi.org/10.1094/mpmi-5-330. DOI: https://doi.org/10.1094/MPMI-5-330
Pieterse, C. M.; Van Pelt, J. A.; Van Wees, S. C.; Ton, J.; Léon-Kloosterziel, K. M.; Keurentjes, J. J. and Van Loon, L. C. 2001. Rhizobacteria-mediated induced systemic resistance: triggering, signalling and expression. Eur. J. Plant Pathol. 107(1):51-61. https://doi.org/10.1023/a:1008747926678. DOI: https://doi.org/10.1023/A:1008747926678
Preston, G. M. 2004. Plant perceptions of plant growth-promoting Pseudomonas. Philosophical Transactions of the Royal Society of London. Series B. Biol. Sci. 359(1446):907-918. https://doi.org/10.1098/rstb.2003.1384. DOI: https://doi.org/10.1098/rstb.2003.1384
Quan, C. S.; Wang, X. and Fan, S. D. 2010. Antifungal compounds of plant growth promoting rhizobacteria and its action mode. In: plant growth and health promoting bacteria. Springer, Berlin, Heidelberg. 117-156 pp. https://doi.org/10.1007/978-3-642-13612-2-6. DOI: https://doi.org/10.1007/978-3-642-13612-2_6
Raaijmakers, J. M.; De Bruijn, I. and de Kock, M. J. 2006. Cyclic lipopeptide production by plant-associated Pseudomonas spp.: diversity, activity, biosynthesis, and regulation. Mol. Plant-Microbe Interactions. 19(7):699-710. https://doi.org/10.1094/mpmi-19-0699. DOI: https://doi.org/10.1094/MPMI-19-0699
Ramette, A.; Frapolli, M.; Fischer-Le Saux, M.; Gruffaz, C.; Meyer, J. M.; Défago, G.; Sutra, L. and Moënne-Loccoz, Y. 2011. Pseudomonas protegens sp. nov., widespread plant-protecting bacteria producing the biocontrol compounds 2,4-diacetylphloroglucinol and pyoluteorin. System. Appl. Microbiol. 34(3):180-188. https://doi.org/10.1016/j.syapm. 2010.10.005. DOI: https://doi.org/10.1016/j.syapm.2010.10.005
Ran, L. X.; Li, Z. N.; Wu, G. J.; Van Loon, L. C. and Bakker, P. A. H. M. 2005. Induction of systemic resistance against bacterial wilt in Eucalyptus urophylla by fluorescent Pseudomonas spp. Eur. J. Plant Pathol. 113(1):59-70. https://doi.org/10.1007/s10658-005-0623-3. DOI: https://doi.org/10.1007/s10658-005-0623-3
Rathinasabapathi, B.; Liu, X.; Cao, Y. and Ma, L. Q. 2018. Phosphate-solubilizing Pseudomonads for improving crop plant nutrition and agricultural productivity. In: Crop Improvement Through Microbial Biotechnology. Elsevier. 363-372 pp. https://doi.org/10.1016/b978-0-444-63987-5.00018-9. DOI: https://doi.org/10.1016/B978-0-444-63987-5.00018-9
Rhodes, D. J. and Powell, K. A. 1994. Biological seed treatments the development process. BCPC Monograph. 57:303-310.
Sah, S. and Singh, R. 2015. Siderophore: structural and functional characterisation a comprehensive review. Agriculture Pol’nohospodárstvo. 61(3):97-114. https://doi.org/ 10.1515/agri-2015-0015. DOI: https://doi.org/10.1515/agri-2015-0015
Schwanemann, T.; Otto, M.; Wierckx, N. and Wynands, B. 2020. Pseudomonas as versatile aromatics cell factory. Biotechnol. J. 15(11):1900569. https://doi.org/10.1002/biot. 201900569.
Smirnov, V. A. and Kiprianova, E. A. 1990. Bacteria of Pseudomonas genus. Kiev. Naukova Dumka. 264 p.
Thomashow, L. S. 2013. Phenazines in the environment: microbes, habitats, and ecological relevance. In Microbial phenazines. Springer, Berlin, Heidelberg. 199-216 pp. https://doi.org/10.1007/978-3-642-40573-0-10. DOI: https://doi.org/10.1007/978-3-642-40573-0_10
Troppens, D. M.; Chu, M.; Holcombe, L. J.; Gleeson, O.; O’Gara, F.; Read, N. D. and Morrissey, J. P. 2013. The bacterial secondary metabolite 2, 4-diacetylphloroglucinol impairs mitochondrial function and affects calcium homeostasis in Neurospora crassa. Fungal Genetics and Biology. 56:135-146. https://doi.org/10.1016/j.fgb.2013.04.006. DOI: https://doi.org/10.1016/j.fgb.2013.04.006
Turner, J. M. and Messenger, A. J. 1986. Occurrence, biochemistry and physiology of phenazine pigment production. Adv. Microbial Physiol. 27:211-275. https://doi.org/10.1016/ s0065-2911(08)60306-9. DOI: https://doi.org/10.1016/S0065-2911(08)60306-9
Van Loon, L. C.; Bakker, P. A. H. M. and Pieterse, C. M. J. 1998. Systemic resistance induced by rhizosphere bacteria. Ann Review Phytopathol. 36(1):453-483. https://doi.org/10.1146/ annurev.phyto.36.1.453. DOI: https://doi.org/10.1146/annurev.phyto.36.1.453
Van Peer, R. and Schippers, B. 1992. Lipopolysaccharides of plant-growth promoting Pseudomonas sp. strain WCS417r induce resistance in carnation to Fusarium wilt. Netherlands J. Plant Pathol. 98(2):129-139. https://doi.org/10.1007/bf01996325. DOI: https://doi.org/10.1007/BF01996325
Weller, D. M.; Landa, B. B.; Mavrodi, O. V.; Schroeder, K. L.; De La Fuente, L.; Blouin, B. S. and Thomashow, L. S. 2007. Role of 2, 4‐diacetylphloroglucinol‐producing fluorescent Pseudomonas spp. in the defense of plant roots. Plant Biol. 9(1):4-20. https://doi.org/10.1055/s-2006-924473. DOI: https://doi.org/10.1055/s-2006-924473
Weller, D. M.; Raaijmakers, J. M.; Gardener, B. B. M. and Thomashow, L. S. 2002. Microbial populations responsible for specific soil suppressiveness to plant pathogens. Ann. Review Phytopathol. 40(1):309-348. https://doi.org/10.1146/annurev.phyto.40.030402.110010. DOI: https://doi.org/10.1146/annurev.phyto.40.030402.110010
Wendenbaum, S.; Demange, P.; Dell, A.; Meyer, J. M. and Abdallah, M. A. 1983. The structure of pyoverdine Pa, the siderophore of Pseudomonas aeruginosa. Tetrahedron Letters. 24(44):4877-4880. https://doi.org/10.1016/s0040-4039(00)94031-0. DOI: https://doi.org/10.1016/S0040-4039(00)94031-0
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2022 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


