Estabilidad del explante en la proliferación de brotes axilares in vitro de la biznaga
DOI:
https://doi.org/10.29312/remexca.v13i1.2309Palabras clave:
cactáceas de ornato, cultivo in vitro, reguladores de crecimientoResumen
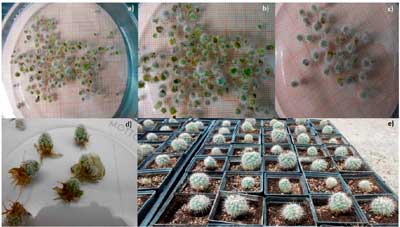
Para conservar ex situ, promover el uso y la potenciación de germoplasma nativo de interés ornamental como T. viereckii subsp. major una especie en estatus de riesgo Pr, se planteó la presente investigación con el objetivo de regenerar esta especie en el laboratorio de cultivo de tejidos vegetales (LCTV) del Campo Experimental Saltillo CIRNE-INIFAP considerando la estabilidad del explante durante subcultivos subsecuentes, determinar el tipo y la concentración de fitohormonas y la mejor relación citocinina-auxina que más influyen en la etapa de multiplicación in vitro. El segmento intermedio del tallo (SIT) obtenido a partir de vitroplantas se usó como explante. De 2017 a 2019 se evaluó la etapa de multiplicación utilizando el medio Murashige-Skoog al 50% de sus macrosales. Un diseño experimental completamente al azar con arreglo factorial, se usó para evaluar dos citocininas: 6-bencil aminopurina (BAP) y 6-furfuryl aminopurina (KIN) en cuatro concentraciones 2.5, 5, 7.5 y 10 mg L-1 en interacción con dos auxinas: ácido naftalenacético (ANA) y ácido indolbutírico (AIB) en una relación citocinina-auxina de 10:1. Se evaluaron 16 tratamientos estableciendo cinco SIT/frasco con 10 repeticiones/tratamiento. Esta evaluación se repitió cinco veces mediante subcultivos, evaluando cada diez semanas el número de brotes/explante (Nb) y la altura del brote (Ab, mm). El análisis de varianza (Anova) demostró que hubo estabilidad del explante durante los subcultivos manteniendo una tasa de multiplicación semejante por más de tres años, efecto importante para una multiplicación intensiva. Al analizar los tratamientos como efectos independientes en la prueba de medias de Tukey (p≤ 0.05), se seleccionó la interacción BAP: AIB y KIN: AIB con las concentraciones de 5 mg L-1 de BAP + 0.5 mg L-1 de AIB y 2.5 mg L-1 de KIN + 0.25 mg L-1 de AIB como los tratamientos que inducen brotes con una tasa de multiplicación de 9.25 brotes/explante con una Ab de 6.73 mm.
Descargas
Citas
Aggarwal, D.; Upadhyay, S. K.; Kumar, K.; Sehrawat, N.; Tuli, H. S. and Singh, R. 2018. Effects of plant growth regulators on in vitro propagation of economically important ornamental plant Rosa hybrida L. Asian J. Biol Life Sci. 9(2):227-233. Doi :10.5530/ajbls.2018.9.35.
Ascough, G. D. and Staden, V. J. 2010. Micropropagation of Albuca bracteata and A. nelsonii indigenous ornamentals with medicinal value. South Afr. J. Bot. 76(3):579-584. https://www.researchgate.net/publication/337387811.
Bianchetti, R. E.; Ferrara, R. C.; Sacramento, P. V.; Floriano, D. F.; Mystica, S. de O A.; Condé, E. F J. and Pereira, P. P. H. 2017. An improved protocol for in vitro propagation of the medicinal plant Mimosa pudica L. Afr. J. Biotechnol. 16(9):418-428. Doi:10.5897/ AJB2016.15831.
Cantos-Cevallos, G.; Pinargote-Choez, J. y Palma-Ponce R. 2018. Influencia de la fitohormona kinetina en el crecimiento de plántulas de Coffea arabiga L. injertadas sobre patrón robusta en vivero. Rev. Cubana Ciencias Forestales. Pinar del Río. 6(2):134-145. http://scielo.sld. cu/scielo.php?script=sci-arttext&pid=s231034692018000200134&lng=es&nrm=iso.
Cardarelli, M.; Borgognone, D. y Colla, G. 2010. Propagación in vitro de Obregonia denegrii (Cactaceae). Propagación de plantas ornamentales. 10(1):29-36. https://www.researchgate. net/publication/262261883.
Castro-Gallo, I.; Meza-Rangel, E.; Pérez-Reyes, M. E. y Pérez-Molphe, B. M. E. 2002. Propagación in vitro de 10 especies mexicanas de cactáceas. Sciantiae Naturae. 4(2):5-24.
Choreño, T. J.; González, M. R. H.; Terrazas, T. S. y Hernández, L. A. 2002. Propagación in vitro de Cephalocereus senilis Haworth Pfeiffer a partir de areolas. Rev. Chapingo. Ser. Hortic. 8(2):183-196. https://doi.org/10.5154/r.rchsh.2001.01.008.
Dávila, F. C. A.; De La Rosa-Carrillo, M. L. and Pérez, B. M. 2005. In vitro propagation of eight species or subspecies of Turbinicarpus (Cactaceae). In vitro Cel. Dev. Biology-Plant. 41(4):540-545. https://doi.org/10.1079/IVP2005668.
De la Rosa-Carrillo, M. L.; Domínguez-Rosales, M. S.; Pérez-Reyes, M. E. y Pérez-Molphe-Balch, E. 2012. Cultivo y propagación in vitro de cactáceas amenazadas del género Turbinicarpus. Interciencia. 37(2):114-120. http://www.redalyc.org/articulo.oa?id=33922717006.
Espinoza-Flores, A.; González-Rosas, H. y Mejía-Muñoz, J. 2003. La comercialización de plantas en peligro de extinción. In: plantas nativas de México con potencial ornamental. Universidad Autónoma, Chapingo (UACH). AMEHOAC. Asociación Mexicana de Horticultura Ornamental, AC. Texcoco, Estado de México, México. 199-217 pp.
Finti, I. A.; Boullani, E. R.; Ayadi, E. F.; Aabd, A. N. and Mousadik, E. A. 2012. Micropropagation in vitro of Opuntia Ficus-indica in south of Morocco. Int. J. Chem. Biochem. Sci. 1:6-10. http://www.iscientific.org/wp-content/uploads/2018/02/2-IJCBS-12-1-06.pdf.
Gámez, M.; Villavicencio, O. E. E. G.; Serrato, M. A. C.; Mejía, J. M. M.; Treviño, G. C.; Martínez, L. G.; Rodríguez, M. O.; Granada, L. C.; Flores, M. C.; Reyes, J. S.; Islas, M. L.; Salome, E. C.; Menchaca, R. A. G.; Espadas, C. M. M.; Hernández, L. S.; Vázquez, L.M. C.; Martínez, G. F. M.; Vargas, O. P. y Ríos, E. S. 2016. Conservación y aprovechamiento sostenible de especies ornamentales nativas de México. Servicio Nacional de Inspección y Certificación de Semillas (SNICS)-Universidad Autónoma Chapingo (UACH). Texcoco, Estado de México, México. 152 p. https://www.gob.mx/cms/uploads/attachment/ file/172778/Conservaci-n-y-aprovechamiento-sostenible-de-especies-ornamentales-de-M-xico.pdf.
Giusti, P.; Vitti, D.; Fiocchetti, F.; Colla, G.; Saccardo, F. and Tucci, M. 2002. In vitro propagation of three endangered cactus species. Sci. Hortic. 95(4):319-332. https://www.sciencedirect.com/science/article/abs/pii/S0304423802000316?via%3Dihub.
Gonçalves, M. L.; Machado, P. S. M. de Fátima.; Ballesta, P.; Mora, F.; Milaneze, G. M. A. y Aparecida, M. C. 2016. Suplementos orgánicos para el cultivo in vitro del híbrido Laeliocattleya (Orchidaceae). Idesia. 1(34):47-54. http://dx.doi.org/10.4067/S0718-34292016000100006.
Granada, C. L. 2014. La importancia del sector ornamental como un potencial de alto contenido de participación social. In: primer simposio nacional plantas ornamentales nativas mexicanas con potencial comercial. SNICS-SINAREFI. Tezoyuca. Morelos México. 10 p.
Guzmán, U.; Arias, M. S. y Dávila, P. P. 2003. Catálogo de cactáceas mexicanas. Universidad Nacional Autónoma de México (UNAM)- Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO). México, DF. México. 315 p. https://www.worldcat.org/ title/catalogo-de-cactaceas-mexicanas/oclc/948238461.
Hunt, D. 2006. The new cactus lexicon. descriptions & illustrations of the cactus family. Compiles and edited by members or the International Cactaceae Systematic Group. England. (Ed.). 373 p. https://www.nhbs.com/the-new-cactus-lexicon-volumes-i-and-ii-book.
Martínez-Villegas, Y. M.; Andrade-Rodríguez, M.; Villegas-Monter, A.; Alia-Tejacal, I.; Villegas-Torres O. G. y López-Martínez, V. 2011. Cultivo in vitro de pitayo (Stenocereus stellatus [Pfeiffer] Riccobono). Rev. Chapingo Hortic. 17(3):95-105. https://doi.org/10.5154/r. rchsh. 2011.17.021.
Mata-Rosas, M.; Monroy-De la Rosa, M. A.; Moebius-Goldammer, K. and Chávez-Ávila, V. M. 2001. Micropropagation of Turbinicarpus laui Glass et Foster, an endemic and endangered species. In vitro Cell. Dev. Pl. 37:400-404. https://doi.org/10.1007/s11627-001-0070-6.
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiologia Plantarum. 15(3):473-477. http://dx.doi.org/10.1111/j.1399-3054.1962.tb08052.x.
Ordoñez, M. M. A. 2003. Propagación in vitro de Mammillaria voburnensis Scheer. (Cactaceae) Universidad de San Carlos de Guatemala. Facultad de Ciencias Químicas y Farmacia. Guatemala. 70 p. http://biblioteca.usac.edu.gt/tesis/06/06-2162.pdf.
Pérez-Molphe-Balch, E.; Pérez-Reyes, M. E.; Villalobos-Amador, E.; Meza-Rangel, E.; Morones-Ruiz, L. R. and Lizalde-Viramontes, H. J. 1998. Propagation of 21 species of mexican cacti by axillary proliferation. In vitro Cell. Dev. Pl. 34(2):131-135. https://doi.org/10.1007/BF02822777.
Pérez-Molphe-Balch E. and Dávila-Figueroa, C. A. 2002. In vitro propagación de Pelecyphora aselliformis Ehrenberg y P. strobiliformis Werdermann (Cactaceae). In Vitro Cel. Develop. Biol. Plant. 38(1):73-78. https://link.springer.com/article/10.1079%2FIVP2001248.
Pérez-Molphe-Balch, E.; Santos-Díaz, M. S.; Ramírez-Malagón, R. y Ochoa-Alejo, N. 2015. Cultivo de tejidos de cactus ornamentales. Sci. Agric. 72(6):540-561. https://www.scielo.br/j/sa/a/VtcbrDrxhm8L3yLFDcfV46j/?lang=en.
Ramírez-Malagón, R.; Aguilar-Ramírez, I.; Borodanenko, A.; Pérez-Moreno, L.; Barrera-Guerra, J. L.; Nulez-Palenius, H. G. and Ochoa-Alejo, N. 2007. In vitro propagation of ten thratened species of Mammillaria (Cactaceae). In vitro Cell. Dev. Pl. 43(6):660-665. https://agris.fao.org/agris-search/search.do?recordID=US201500203765.
SEMARNAT. 2010. Secretaría del Medio Ambiente y Recursos Naturales. Norma Oficial Mexicana NOM-059-ECOL-2010. Protección ambiental-especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio. Lista de especies en riesgo. Diario Oficial de la Federación. 30 de diciembre de 2010. México, DF. 130 p. https://dof.gob.mx.
Soltero, Q. R. y Portillo L. 2015. Micropropagación de cactáceas mexicanas amenazadas. Bol. Nakari. 26(2):13-17. https://www.researchgate.net/publication/285204536.
Soria-Campos, D.; López-Escamilla, A. L. y Olguín-Santos, L. P. 2013. Propagación in vitro de Mammillaria schiedeana schiedeana (Cactaceae), subespecie endémica y amenazada de extinción de la Barranca de Metztitlán, Hidalgo. Estudios científicos en el estado de Hidalgo y zonas aledañas. Lincoln, NE. Zea Books. 2(16):121-128. https://digitalcommons.unl.edu/cgi/viewcontent.cgi?article=1015&context=hidalgo.
SAS. 2019. Statistical Analysis System Institute Inc. SAS/STAT®14.1 User’s guide second edition. SAS Institute Inc. Raleigh, NC, USA. 238 p.
Tropicos. 2019. Trópicos: Turbinicarpus viereckii subsp. major (Glass & R.A. Foster) Glass). http://www.tropicos.org/Name/33700793.
Velázquez E. L. E. y Soltero, Q. R. 2001. Micropropagación de Ephithelantha micromeris Engelm. Weber ex Britton et Rose. 46(3):56-62.
Villanueva, F.; Ávila, M.; Mansilla, A.; Abades, S. y Cáceres, J. 2013. Efecto de auxinas y citoquininas en el cultivo de tejido de Ahnfeltia plicata (Hudson) Fries, 1836 (Ahnfeltiales, rhodophyta) de la región de Magallanes. Anales Instituto Patagonia. Punta Arenas, Chile. 1(41):99-111. http://dx.doi.org/10.4067/S0718-686X2013000100009.
Villavicencio-Gutiérrez, E. E.; González-Cortes, A.; Arredondo-Gómez, A.; Iracheta-Donjuan, L.; Comparan-Sánchez, S. y Casique-Valdés, R. 2011. Micropropagación de Turbinicarpus knuthianus (Boed.) John & Riha cactácea ornamental, amenazada de extinción del Desierto Chihuahuense. Rev. Mex. Cien. Forest. 6(2):37-56. https://doi.org/10.29298/rmcf. v2i6.573.
Villavicencio, G. E. E.; González, C. A. y Carranza, P. M. A. 2012. Micropropagación de Epithelantha micromeris (Engelm.) F.A.C. Weber ex Britt. & Rose cactácea ornamental y recurso fitogenético del Desierto Chihuahuense. Rev. Mex. Cien. Forest. 14(3):83-99. Doi: https://doi.org/10.29298/rmcf.v3i14.476.
Villavicencio, G. E. E.; Arellano, O. G. y Belmontes, D. V. A. 2020. Micropropagación del órgano pequeño sacasil (Echinocereus poselgeri Lem.) (Fam.: Cactaceae). Acta Hortic. 1288(1):123-130. Doi: 10.17660/ActaHortic.2020.1288.19.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2022 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


