Co-inoculation with rhizobia and arbuscular mycorrhizal fungi in seedlings of Prosopis laevigata
DOI:
https://doi.org/10.29312/remexca.v12i7.2910Keywords:
Rhizobium, forage legumes, HMAAbstract
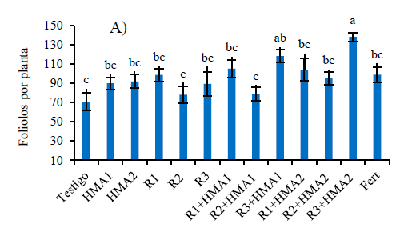
Inoculation with rhizobia and arbuscular mycorrhizal fungi (HMA), single or combined, may contribute to the growth and establishment of Prosopis laevigata because of a positive interaction of symbionts with the plant. The objective was to evaluate the effect of single and combined inoculation of three local isolates of rhizobia (R1, R2 and R3) and two strains of HMA (HMA1 and HMA2) on mycorrhizal colonization, nodulation, growth and biomass production of P. laevigata in substrate with pH close to neutrality. The experiment was carried out in a greenhouse, at the Faculty of Agronomy and Veterinary of the UASLP in 2020-2021. Thirteen treatments were evaluated in a completely randomized design with five repetitions. The variables studied were number of spores g-1 of substrate, mycorrhizal colonization and visual density, total nodules, effective nodules, number of leaflets, height, stem diameter and biomass yield. Inoculation promoted greater colonization, nodulation and plant growth with respect to the non-inoculated control. With HMA1, HMA2, R1, R3, R1+HMA1, R3+HMA1, R1+HMA2 and R3+HMA2, results superior to those of the rest of the treatments were obtained. It is concluded that inoculation with local isolates of rhizobia and their combination with HMA favors the development of mycorrhizal structures, nodulation, growth and biomass production of P. laevigata grown in substrate with neutral pH. Isolates R1, R3, strains HMA1, HMA2 and combinations R1+HMA1, R1+HMA2, R3+HMA1 and R3+HMA2 were registered as effective inoculants to increase the growth of P. laevigata.
Downloads
References
Balatti, P. A. 1996. Interacciones tempranas Rhizobio-leguminosa. Rev. de la Facultad de Agronomía. 101(1):91-108. http://sedici.unlp.edu.ar/handle/10915/69406.
Bianco, L. y Cenzano, A. M. 2018. Leguminosas nativas: estrategias adaptativas y capacidad para la fijación biológica de nitrógeno. Implicancia ecológica. IDESIA. Chile. Arica. 36(4):71-80. http://dx.doi.org/10.4067/S0718-34292018005002601.
Budowski, G. 1984. Los sistemas agroforestales en América Central. In: agroforestería. Actas del Seminario. (Ed). J. Heuveldop y J. Lagemann. CATIE. Turrialba, Costa Rica. 112 p.
Cantaro-Segura, H.; Huaringa-Joaquín, A. y Zúñiga-Dávil, D. 2019. Efectividad simbiótica de dos cepas de Rhizobium sp. en cuatro variedades de frijol (Phaseolus vulgaris L.) en Perú. Idesia (Arica). 37(4):73-81. Doi: https://dx.doi.org/10.4067/S0718-34292019000400073.
Crespo, G. 2009. Recuperación de la fertilidad del suelo en áreas ganaderas degradadas Rev. Cubana de Ciencia Agrícola. Instituto de Ciencia Animal. 43(4):355-360. https://www.redalyc.org/pdf/1930/193014888005.pdf. Das, A. and Varma, A. 2009. Symbiosis: ‘the art of living’. In: (Ed.). Varma, A. and Kharkwal, A. C. Symbiotic Fungi,). (Ed.). Springer Berlin Heidelberg. Soil Biol. 18. 1-28 pp. ISBN 978-3-540-95893-2. doi: 10.1007/978-3-540-95894-9-1. FAO. 1985. Les inoculums de légumineuses et leurs applications. Organisation des Nations Unies pour l’Alimentation et l´Agriculture. Roma. 63 p. De Souza, D.; Colozzi-Filho, A.; Balota, E. L. and Hungria, M. 2003. Long-term effects of agricultural practices on microbial community. In: García-Torres, L; Benites, J.; Martínez-Vilela, A. and Holgado-Cabrera, A. (Ed.). Conservation Agriculture. Springer, Dordrecht. 301-306 pp. https://doi.org/10.1007/978-94-017-1143-2-36. Gardezi, A. K.; Márquez-Berber, S. R.; Velarde, E. V.; Escobar, M. O.; Escalona-Maurice, M. J.; Haro-Aguilar, G. y Larqué-Saavedra, M. U. 2020. Inoculación de (Prosopis laevigata) por hongos micorrízicos arbusculares en diferentes dosis de materia orgánica en dos tipos de suelo. Inter. J. Environ. Agric. Res. 5(11):01-08. doi: https://dx.doi.org/10.5281/ zenodo.4297161. Giovannetti, M. and Mosse, B. 1980. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytologist. 84(3):489-500. https://www.jstor.org/stable/2432123. González, P. J.; Ramírez, J. F.; Rivera, R.; Hernández, A. y Crespo, G. 2016. Efectividad de la inoculación de hongos micorrízicos arbusculares en dos leguminosas forrajeras cultivadas en dos tipos de suelos. Tropical Grassland. 4(2):82-90. doi: 10.17138/TGFT(4)82-90.
Gryndler, M.; Hršelová, H.; Cajthaml, T.; Havránková, M.; Rezácová, V.; Gryndlerová, H. and Larsen, J. 2009. Influence of soil organic matter decomposition on arbuscular mycorrhizal fungi in terms of symbiotic hyphal growth and root colonization. Mycorrhiza. 19(4):255-266. https://doi.org/10.1007/s00572-008-0217-y. Herrera, R. A.; Ferrer, R. L.; Furrazola, E. y Orozco, M. O. 1995. Estrategia de funcionamiento de las micorrizas VA en un bosque tropical. Biodiversidad en Iberoamérica. Ecosistemas, Evolución y Procesos sociales. (Ed.). Monasterio, M. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo. Subprograma XII. Diversidad Biológica. Mérida.
João, J. P.; Espinosa, A.; Ruiz, L.; Simó, J. y Rivera, R. 2016. Efectividad de cepas de HMA en el cultivo de la yuca (Manihot esculenta Crantz) en dos tipos de suelos. Cultivos Tropicales. 37(1):48-56. http://scielo.sld.cu/scielo.php?script=sci-arttext&pid=S0258-59362016000 100007 &lng =es&tlng=es.
Kulkarni, S. and Nautiyal, C. S. 1999. Characterization of high-temperature tolerant rhizobia isolated from Prosopis juliflora grown in alkaline soil. J. Gen. Appl. Microbiol. 45(5):213-220. https://doi.org/10.2323/jgam.45.213.
Lara, L.; Hernández, L. G.; Reyes, J. J.; Rangel, P. P. y Zulueta, R. 2019. Respuesta agronómica de Phaseolus vulgaris a la biofertilización en campo. Rev. Mex. Cienc. Agríc. 10(5):1035-1046. https://doi.org/10.29312/remexca.v10i5.936.
Leigh, J.; Hodge, A. and Fitter, A. H. 2009. Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytol. 181(1):199-207. https://doi.org/10.1111/j.1469-8137.2008.02630.x. Monroy-Ata, A.; Estévez-Torres, J.; García-Sánchez, R. y Ríos-Gómez, R. 2007. Establecimiento de plantas mediante el uso de micorrizas y de islas de recursos en un matorral xerófilo deteriorado. Boletín de la Sociedad Botánica de México 80. 49-57 pp. doi: 10.17129/botsci.1756.
NC 51. 1999. Determinación del por ciento de materia orgánica. Manual de procedimientos. Comité Técnico de Normalización Núm. 3. Calidad del suelo. Análisis químico. La Habana. Oficina Nacional de Normalización. 9 p.
NC 52. 1999. Determinación de las formas móviles de fósforo y potasio. Manual de procedimientos. Comité Técnico de Normalización Núm. 3. Calidad del suelo. Análisis químico. La Habana. Oficina Nacional de Normalización. 12 p.
NC ISO 10390. 1999. Determinación de pH. Manual de procedimientos. Comité Técnico de Normalización Núm. 3. Calidad del suelo. Análisis químico. La Habana. Oficina Nacional de Normalización. 10 p.
Paneque, V. M. y Calaña, J. M. 2001. La fertilización de los cultivos. Aspectos teórico-prácticos para su recomendación. Departamento de biofertilizantes y nutrición de las plantas. La Habana. INCA. 29 p.
Palacios, R. A.; Rodríguez, L. R. y Hernández, F. M. 2016. Distribución potencial de Prosopis laevigata (Humb. & Bonpl. ex Willd) MC Johnston basada en un modelo de nicho ecológico. Rev. Mex. Cienc. Bosque. 34(7):35-46. doi:10.29298/rmcf.v7i34.81.
Phillips, J. M. and Hayman, D. S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycororrhizal fungi for rapid assessment to infection. Trans. Brit. Mycol. Soc. 55(1):158-161. https://www.cabdirect.org/cabdirect/abstract/ 19711101080. Pinos-Rodríguez, J. M.; García-López, J. C.; Peña-Avelino, J. A.; Rendo-Huerta, J. A.; González-González, C. y Tristán, P. F. 2012. Impactos y regulaciones ambientales del estiércol generado por los sistemas ganaderos de algunos países de América. Agrociencia. 46(4):359-370. http://www.scielo.org.mx/scielo.php?script=sci-arttext&pid=S1405-31952 012000400004.
Posada, R. H.; Franco, L. A.; Ramos, C.; Plazas, L. S.; Suárez, J. C. and Álvarez, F. 2008. Effect of physical, chemical and environmental characteristics on arbuscular mycorrhizal fungi in Brachiaria decumbens (Stapf) pastures. J. Appl Microbiol. 104(1):132-140. https://doi.org/ 10.1111/j.1365-2672.2007.03533.x.
Quintana, L. J.; Herrera, R.; Furrazola, E. y Hernández, C. 2014. Efecto de inoculaciones conjuntas de Rhizobium-Micorrizas Arbusculares en Leucaena leucocephala CV: Perú. Centro Agrícola. 41(3):17-21. https://www.researchgate.net/publication/280577699-Efecto-de-inoculaciones-conjuntas-de-rhizobium-micorrizas-arbusculares-en-eucaena-leucocephala-CV-Peru.
Rabie, G. H.; Aboul-Nasr, M. B. and Al-Humiany, A. 2005. Increased salinity tolerance of cowpea plants by dualinoculation of an arbuscular mycorrhizal fungus Glomus clarum and a nitrogen-fixer Azospirillum brasilense. Mycobiology. 33(1):51-60. doi:10.4489/MYCO. 2005.33.1.051.
Rivera, R. y Fernández, K. 2003. Bases científico-técnicas para el manejo de los sistemas agrícolas micorrizados eficientemente. In: Rivera, R. y Fernández, K. (Ed.). Manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: el Caribe. INCA. La Habana. 166-169. Doi:10.13140/2.1.1813.9203.
Rodríguez, E. N.; Rojo, G. E.; Ramírez, B.; Martínez, R.; Cong Hermida, M de la C.; Medina, S. M. y Piña, H. H. 2014. Análisis técnico del árbol del mezquite (Prosopis laevigata Humb. & Bonpl. Ex Willd.) En México. Ra Ximhai. 10(3):173-193. https://www.redalyc.org /articulo.oa?id=46131111013.
SEMARNAT. 2015. Informe de la Situación Medio Ambiente en México. https://apps1.semarnat.gob.mx:8443/dgeia/informe15/tema/pdf/Informe15-completo.pdf. Tapia, J.; Ferrera, R. J.; Varela, L.; Rodríguez, J. C.; Soria, J. C. y Tiscareño, M. A. 2010. Infectividad y efectividad de hongos micorrízicos arbusculares nativos de suelos salinos en el cultivo de lechuga (Lactuca sativa). Rev. Mex. Micol. 31:69-74. http://www.scielo.org.mx/scielo.php?script=sci-arttext&pid=S0187-31802010000100010. Toro, M.; Bazó, I. y López, M. 2008. Micorrizas arbusculares y bacterias promotoras de crecimiento vegetal, Biofertilizantes nativos de sistemas agrícolas bajo manejo conservacionista. Agronomía Tropical. 58(3):215-221. http://ve.scielo.org/scielo.php? script=sci-arttext&pid=S0002-192X2008000300002&lng= es&nrm=iso. Trouvelot, A.; Kough, J. L. and Gianinazzi-Pearson, V. 1986. Mesure du taux de micorrización VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. In: Gianinazzi-Pearson V. and Gianinazzi, S. (Ed). Physiological and genetical aspects of mycorrhizae. INRA, Paris. 217-221 pp.
Velázquez, E.; Igual, J. M.; Willems, A.; Fernández, M. P.; Muñoz, E.; Mateos, P. F.; Abril, A.; Toro, N.; Normy, P.; Cervantes, M.; Gillis, M. y Martínez-Molina, E. 2001. Mesorhizobium chacoense sp. nov, a novel species that nodulates Prosopis alba in the Chaco Arido region, Argentina. Int. J. Syst. Evol. Microbiol. 51(3):1011-1021. https://doi.org/10.1099/ 00207713-51-3-1011.
Vierheilig, H. 2004. Regulatory mechanisms during the plant - arbuscular mycorrhizal fungus interaction. Canadian J. Bot. 82(8):1166-1176. https://doi.org/10.1139/b04-015.
Vincent, J. M. A. 1970. Manual for the practical study of rootnodule bacteria. In: International Biological Programme Handbook. Blackwele scientific num. 15. 1-13 pp. https://www.scielo.br/scielo.php?script=sci-nlinks&ref=000149&pid=S0100-068320090 0050001500031&lng=en.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2021 Revista Mexicana de Ciencias Agrícolas

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Revista Mexicana de Ciencias Agrícolas accept the following conditions:
In accordance with copyright laws, Revista Mexicana de Ciencias Agrícolas recognizes and respects the authors’ moral right and ownership of property rights which will be transferred to the journal for dissemination in open access. Invariably, all the authors have to sign a letter of transfer of property rights and of originality of the article to Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) [National Institute of Forestry, Agricultural and Livestock Research]. The author(s) must pay a fee for the reception of articles before proceeding to editorial review.
All the texts published by Revista Mexicana de Ciencias Agrícolas —with no exception— are distributed under a Creative Commons License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0), which allows third parties to use the publication as long as the work’s authorship and its first publication in this journal are mentioned.
The author(s) can enter into independent and additional contractual agreements for the nonexclusive distribution of the version of the article published in Revista Mexicana de Ciencias Agrícolas (for example include it into an institutional repository or publish it in a book) as long as it is clearly and explicitly indicated that the work was published for the first time in Revista Mexicana de Ciencias Agrícolas.
For all the above, the authors shall send the Letter-transfer of Property Rights for the first publication duly filled in and signed by the author(s). This form must be sent as a PDF file to: revista_atm@yahoo.com.mx; cienciasagricola@inifap.gob.mx; remexca2017@gmail.
This work is licensed under a Creative Commons Attribution-Noncommercial 4.0 International license.


