Actividad enzimática en Sorghum bicolor por metabolitos microbianos y un extracto vegetal micro-nano encapsulados
DOI:
https://doi.org/10.29312/remexca.v16i5.3755Palabras clave:
bioherbicidas, nanotecnología, extractos vegetales, metabolitosResumen
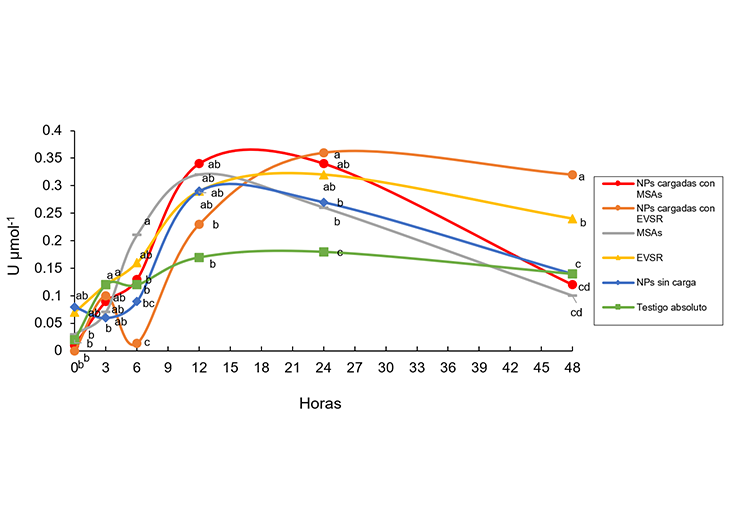
Los herbicidas químicos para control de malezas, representa un problema en la actualidad, ya que su uso indiscriminado causa la aparición de poblaciones resistente de malezas, además de afectar el medio ambiente y la salud humana. Por lo que los metabolitos secundarios de microrganismos (MSMs) y los extractos vegetales (EVs) en formulaciones micro-nano encapsulados (NPs) surgen como una posible alternativa al uso de herbicidas de síntesis química, razón por la cual dilucidar su mecanismo de acción es necesario para entender los cambios bioquímicos que estos inducen en las plantas, para poder desarrollar estrategias de control de malezas. El objetivo de la investigación fue determinar la actividad de las enzimas antioxidantes fenilalanina amonio liasa (PAL), peroxidasa (POD) y super oxido dismutasa (SOD) en plantas de Sorghum bicolor, tratadas con metabolitos secundarios de Alternaria sp. (MSAs) y un extracto vegetal de Solanum rostratum (EVSR) solos y formulados en NPs a base de los biopolímeros alginato y quitosan. El estudio se realizó durante el mes de junio del año 2024, para esto se utilizaron plantas de S. bicolor y se determinó la actividad de las enzimas durante 0, 3, 6, 12, 24 y 48 h. Se pudo observar que los NPs cargados con el EVSR y los MSAs fueron los que indujeron mayor actividad enzimática a distintos tiempos, alcanzando 0.36 y 0.34 U mol-1 respectivamente en el caso de PAL, 4.7 y 4.3 U mol-1 con la enzima POD, y 7.3 y 6.5 U mol-1 con SOD. Se concluye que los MSAs y el EVSR formulados en NPS tiene potencial como agentes que pueden modificar los procesos bioquímicos en plantas.
Descargas
Citas
Alves, C.; Costa, E.; Sofiatti, J. R.; Forte, C. T.; Winter, F. L.; Holz, C. M. and Galon, L. 2018. Effect of herbicides on the oxidative stress in crop winter species. Anais da Academia Brasileira de Ciências. 90(02):1533-1542. https://doi.org/10.1590/0001-3765201820170482.
Anwar, S.; Naseem, S.; Karimi, S.; Asi, M. R.; Akrem, A. and Ali, Z. 2021. Bioherbicidal activity and metabolic profiling of potent allelopathic plant fractions against major weeds of wheat Way forward to lower the risk of synthetic herbicides. Frontiers in Plant Science. 12:632-390 https://doi.org/10.3389/fpls.2021.632390.
Ascacio-Valdés, J. A.; Aguilera-Carbó, A. F.; Buenrostro, J. J.; Prado-Barragán, A.; Rodríguez-Herrera, R. and Aguilar, C. N. 2016. The complete biodegradation pathway of ellagitannins by Aspergillus niger in solid-state fermentation. Journal of Basic Microbiology. 56(4):329-336. https://doi.org/10.1002/jobm.201500557.
Balah, M. A. 2020. Weed control ability of Egyptian natural products against annual, perennial and parasitic weeds. Acta Ecologica Sinica. 40(6):492-499. https://doi.org/10.1016/j.chnaes.2020.10.005.
Caverzan, A.; Piasecki, C.; Chavarria, G.; Stewart Jr, C. N. and Vargas, L. 2019. Defenses against ROS in crops and weeds: The effects of interference and herbicides. International journal of molecular sciences. 20(5):1086. https://doi.org/10.3390/ijms20051086.
Fancy, N. N.; Bahlmann, A. K. and Loake, G. J. 2017. Nitric oxide functions in plant abiotic stress. Plant, Cell & Environment. 40(4):462-472. https://doi.org/10.1111/pce.12707.
Fernández-Aparicio, M.; Masi, M.; Cimmino, A.; Vilariño, S. and Evidente, A. 2021. Allelopathic effect of quercetin, a flavonoid from Fagopyrum esculentum roots in the radicle growth of Phelipanche ramosa: quercetin natural and semisynthetic analogues were used for a structure-activity relationship investigation. Plants. 10(3):543. https://doi.org/10.3390/plants10030543.
González-Gallegos, E.; Laredo-Alcalá, E.; Ascacio-Valdés, J.; Rodríguez, D. J. and Hernández-Castillo, F. D. 2015. Changes in the production of salicylic and jasmonic acid in potato plants (Solanum tuberosum) as response to foliar application of biotic and abiotic inductors. American Journal of Plant Sciences. 6(11):1785. https://doi.org/10.4236/ajps.2015.611179.
Grewal, S. K.; Gill, R. K.; Virk, H. K. and Bhardwaj, R. D. 2022. Methylglyoxal detoxification pathway-explored for the first time for imazethapyr tolerance in lentil (Lens culinaris L.). Plant Physiology and Biochemistry. 177:10-22. https://doi.org/10.1016/j.plaphy.2022.02.007.
Huang, H.; Ullah, F.; Zhou, D. X.; Yi, M. and Zhao, Y. 2019. Mechanisms of ROS regulation of plant development and stress responses. Frontiers in Plant Science. 10:800. https://doi.org/10.3389/fpls.2019.00800.
Husic, L.; Parić, A. and Mesic, A. 2023. Allelopathic and toxicological effects of Origanum vulgare L. essential oil. Caryologia. 76(1):97-102. https://doi.org/10.36253/caryologia-2132.
Kausar, T.; Jabeen, K.; Javaid, A. and Iqbal, S. 2022. Herbicidal efficacy of culture filtrates of Alternaria brassicicola and Alternaria gaisen against parthenium weed. Advances in Weed Science. 40:e02224640. https://doi.org/10.51694/AdvWeedSci/2022;40:00002.
Kumar, R.; Kumari, V. V.; Gujjar, R. S.; Kumari, M.; Goswami, S. K.; Datta, J. and Hossain, A. 2024. Evaluating the imazethapyr herbicide mediated regulation of phenol and glutathione metabolism and antioxidant activity in lentil seedlings. Peer J. 12:e16370. https://doi.org/10.7717/peerj.16370.
Nohatto, M. A.; Agostinetto, D.; Langaro, A. C.; Oliveira, C. D. and Ruchel, Q. 2016. Antioxidant activity of rice plants sprayed with herbicides. Pesquisa Agropecuária Tropical. 46(1):28-34. https://doi.org/10.1590/1983-40632016v4638011.
Ofosu, R.; Agyemang, E. D.; Márton, A.; Pásztor, G.; Taller, J. and Kazinczi, G. 2023. Herbicide resistance: managing weeds in a changing world. Agronomy. 13(6):1595. https://doi.org/10.3390/agronomy13061595.
Rodríguez-Pedroso, A. T.; Ramírez-Arrebato, M. Á.; Cárdenas-Travieso, R. M.; Falcón-Rodríguez, A. y Bautista-Baños, S. 2006. Efecto de la quitosana en la inducción de la actividad de enzimas relacionadas con la defensa y protección de plántulas de arroz (Oryza sativa L.) contra Pyricularia grisea Sacc. Revista Mexicana de Fitopatología. 24(1):1-7.
Romero-Tejeda, M.; Martínez-Damián, M. T. and Rodríguez-Pérez, J. E. 2015. Effect of storage temperature on enzyme activity and antioxidant capacity in Salvia officinalis L. shoots. Revista Chapingo Serie Horticultura. 21(3):199-213. https://doi.org/10.5154/r.rchsh.2015.01.003.
Sinegovskaya, V. and Dushko, O. 2021. Role of enzyme activity in increasing soybean plants’ resistance to herbicides. In: E3S Web of Conferences. 254:02007. EDP Sciences. https://doi.org/10.1051/e3sconf/202125402007.
Taban, A.; Saharkhiz, M. J. y Kavoosi, G. 2021. Development of pre-emergence herbicide based on Arabic gum-gelatin, apple pectin and savory essential oil nano-particles: a potential green alternative to metribuzin. International Journal of Biological Macromolecules. 167:756-765. https://doi.org/10.1016/j.ijbiomac.2020.12.007.
Todero, I.; Confortin, T. C.; Luft, L.; Brun, T.; Ugalde, G. A.; Almeida, T. C. and Mazutti, M. A. 2018. Formulation of a bioherbicide with metabolites from Phoma sp. Scientia Horticulturae. 241:285-292. https://doi.org/10.1016/j.scienta.2018.07.009.
Traxler, C.; Gaines, T. A.; Küpper, A.; Luemmen, P. y Dayan, F. E. 2023. The nexus between reactive oxygen species and the mechanism of action of herbicides. Journal of Biological Chemistry. 105-267 pp. https://doi.org/10.1016/j.jbc.2023.105267.
Tucuch-Pérez, M. A.; Mendo-González, E. I.; Ledezma-Pérez, A.; Iliná, A.; Hernández-Castillo, F. D.; Barrera-Martinez, C. L. and Arredondo-Valdés, R. 2023. The herbicidal activity of nano-and microencapsulated plant extracts on the development of the indicator plants Sorghum bicolor and Phaseolus vulgaris and their potential for weed control. Agriculture. 13(11):2041. https://doi.org/10.3390/agriculture13112041.
Ureña-Saborío, H.; Madrigal-Carballo, S.; Sandoval, J.; Vega-Baudrit, J. R. and Rodríguez-Morales, A. 2017. Encapsulation of bacterial metabolic infiltrates isolated from different Bacillus strains in chitosan nanoparticles as potential green chemistry-based biocontrol agents against Radopholus similis. Journal of Renewable Materials. 5(3-4):290-299. https://doi.org/10.7569/JRM.2017.634119.
Van Bruggen, A. H.; Finckh, M. R.; He, M.; Ritsema, C. J.; Harkes, P.; Knuth, D. and Geissen, V. 2021. Indirect effects of the herbicide glyphosate on plant, animal and human health through its effects on microbial communities. Frontiers in Environmental Science. 9:763-917. https://doi.org/10.3389/fenvs.2021.763917.
Yedidia, I.; Benhamou, N. and Chet, I. 1999. Induction of defense responses in cucumber plants (Cucumis sativus L.) by the biocontrol agent Trichoderma harzianum. Applied and environmental microbiology. 65(3):1061-1070. https://doi.org/10.1128/AEM.65.3.1061-1070.1999.
Yin, X. L.; Jiang, L.; Song, N. H. and Yang, H. 2008. Toxic reactivity of wheat (Triticum aestivum) plants to herbicide isoproturon. Journal of agricultural and food chemistry. 56(12):4825-4831. https://doi.org/10.1021/jf800795v.
Zabot, G. L.; Schaefer-Rodrigues, F.; Polano-Ody, L.; Vinícius-Tres, M.; Herrera, E.; Palacin, H. and Olivera-Montenegro, L. 2022. Encapsulation of bioactive compounds for food and agricultural applications. Polymers. 14(19):4194. https://doi.org/10.3390/polym14194194.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


