Arvenses potenciales como cultivo trampa para Meloidogyne enterolobii y Nacobbus aberrans
DOI:
https://doi.org/10.29312/remexca.v15i8.3610Palabras clave:
Dysphania ambrosioides, Malva parviflora, Oxalis corniculata, Portulaca oleracea, Tagetes erectaResumen
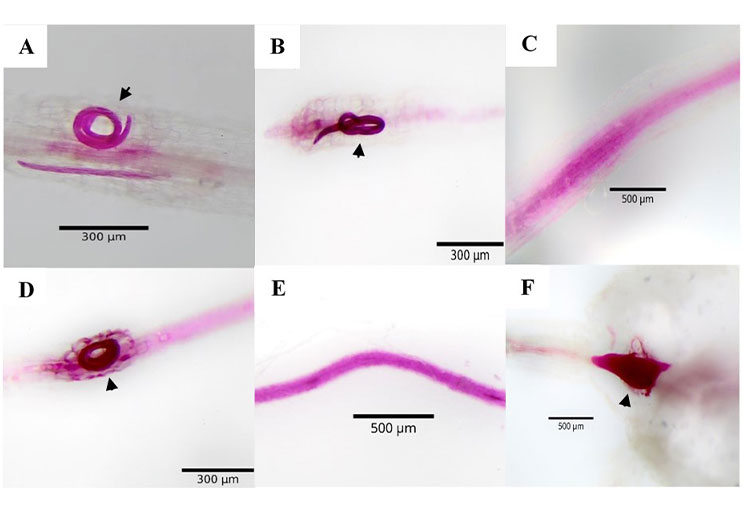
El uso de arvenses como estrategia de manejo agroecológico de fitonematodos ha ganado importancia debido a su implementación como plantas trampa que interfieren en su ciclo biológico, por lo que el objetivo de la presente investigación fue evaluar el porcentaje de reproducción de Meloidogyne enterolobii y Nacobbus aberrans en cinco arvenses. Este experimento se llevó a cabo en el Colegio de Postgraduados, Campus Montecillo, Estado de México, México, en el año 2023. Se usó como referencia de susceptibilidad el genotipo de chile CM-334 (testigo) y cada unidad experimental fue inoculada con 1000 J2 de cada especie de nematodo. Las variables respuesta fueron agallamiento, masas de huevos, huevos, número de hembras y juveniles por g de raíz a los 35 días posteriores a la inoculación (dpi) para Meloidogyne enterolobii y 45 dpi para Na. Se utilizó un diseño experimental completamente al azar con arreglo factorial. Las arvenses Tagetes erecta, Portulaca oleracea, Dysphania ambrosioides, Malva parviflora y Oxalis corniculata presentaron un 100% de disminución en el número de agallas, masas de huevos y huevos por g de raíz para Nacobbus aberrans, con respecto al testigo. Estos dos últimos parámetros fueron similares para Meloidogyne enterolobii. Todas las arvenses evaluadas mostraron un porcentaje de reproducción diferencial para ambos nematodos en el número de hembras e individuos por g de raíz (7.34-100%). Los resultados obtenidos indican que estas arvenses pueden ser utilizadas como cultivo trampa potenciales para el manejo de los nematodos Meloidogyne enterolobii y Nacobbus aberrans.
Descargas
Citas
Byrd, Jr. R.; Kirkpatrick, T. and Barker, K. R. 1983. An improved technique for clearing and staining plant tissues for detection of nematodes. Journal of Nematology. 15(1):142-143.
Cid del Prado, V. I.; Franco, F. N. and Godinez, D. V. 2018. Plant parasitic nematodes and management strategies of major crops in Mexico. In: plant parasitic nematodes in sustainable agriculture of North America, sustainability in plant and crop protection. Subbotin, S. A and Chitambar, J. J Ed. Springer Nature. Switzerland. 31-68 pp.
Cid del Prado, V. I.; Tovar, S. A. y Hernández, J. A. 2001. Distribución de especies y razas de Meloidogyne en México. Revista Mexicana de Fitopatología. 19(1):32-39.
Cook, R. and Starr, J. L. 2006. Resistant cultivars. In: plant nematology. Perry, R. and Moens, M. Ed. CABI. UK. 370-391 pp.
Ferraz, S. y Valle, L. A. 1997. Controle de fitonematoides por plantas antagónicas. Viçosa, MG. Ed. UFV. 73 p.
Filialuna, O.; Wram, C. and Zasada, I. 2022. What is the optimal way to assess Meloidogyne spp. reproduction in greenhouse pot experiments? Journal of Nematology. 54(1):1-9. Doi: 10.2478/jofnem-2022-0012.
Groover, W.; Lawrence, K. S. and Donald, P. 2019. Reproductive rate differences of root-knot nematodes from multiple crops in a single field. Nematropica. 49(2):152-156.
Hussey, R. S. and Janssen, G. J. W. 2004. Root-knot nematode: Meloidogyne species. In: plant resistence to parasitic nematodes. Starr, J. L.; Cook, R. and Bridge, J. Ed. CABI Publishing, New York. 43-70 pp.
Hussey, R. S. and McGuire, J. M. 1987. Interaction with other organisms. In: principles and practice of nematode control in crops. Brown, R. H. and Kerry, B. R. Ed. Academic Press. Australia. 293-328 pp.
Kanchan, B. M.; Jayanthi, M.; Shivani, C.; Uma, R. and Pranab, K. M. 2023. In planta transformation of Polianthes tuberosa for concomitant knockdown of flp-1, flp-12 and flp-18 genes induced root-knot nematode resistance. Scientia Horticulturae. 311(1):1-13. Doi: 10.1016/j.scienta.2022.111764.
Khan, F.; Asif, M.; Khan, A.; Tariq, M.; Ansari, T.; Shariq, M. and Siddiqui, M. A. 2019. Evaluation of the nematicidal potential of some botanicals against root-knot nematode, Meloidogyne incognita infected carrot: in vitro and greenhouse study. Curr. Plant Biol. 20:100115. Doi: 10.1016/j.cpb.2019.100115.
Kirwa, H. K.; Murungi, L. K.; Beck, J. J. and Torto, B. 2018. Elicitation of differential responses in the root-knot nematode Meloidogyne incognita to tomato root exudate cytokinin, flavonoids, and alkaloids. Journal of Agricultural and Food Chemistry. 66(43):11291-11300. Doi: 10.1021/acs.jafc.8b05101.
Manzanilla, L. R.; Costilla, M. A.; Doucet, M.; Franco, J.; Inserra, R. N.; Lehman, P. S.; Cid Del Prado, V. I.; Souza, R. M. and Evans, K. 2002. The genus Nacobbus Thorne and Allen, 1944 (Nematoda: Pratylenchidae): systematics, distribution, biology and management. Nematropica. 32(2):149-227.
Moens, M.; Perry, R. N. and Starr, J. L. 2009. Meloidogyne species is a diverse group of novel and important plant parasites. In: root-knot nematodes. Perry, R. N.; Moens, M. and Starr, J. L. Ed. CAB International. Wallingford. UK. 1-17 pp.
Moreira, F. J.; Santos, C. D.; Innecco, R. y Silva, G. S. 2015. Control alternativo de nematoide das galhas (Meloidogyne incognita) raça 2, con óleos esenciales en solo. Summa Phytopathologica Botucatu. 41(3):207-213.
Ntidi, K. N.; Fourie, H. and Daneel, M. S. 2016. Greenhouse and field evaluations of commonly occurring weed species for their host suitability to Meloidogyne species. International Journal of Pest Management 62(1):11-19. Doi: 10.1080/09670874.2015.1087602.
Oostenbrink, M. 1966. Major characteristics of the relation between nematodes and plant. Wageningen University y Research. Netherlands. 1-46 pp.
Proita, K.; Carneiro, R.; Falcão, R.; Gomes, A.; Leal-Bertioli, S.; Guimarães, P. and Bertioli, D. 2008. Post-infection development and histopathology of Meloidogyne arenaria race 1 on Arachis spp. Plant Pathology. 57(5):974-980. Doi: 10.1111/j.1365-3059.2008.01861.x.
Rich, J. R.; Brito, J. A.; Kaur, R. and Ferrell, J. A. 2009. Weed species as hosts of Meloidogyne: a review. Nematropica. 39(2):157-185.
SAS Institute. 2012. SAS/STAT® 9.3 User’s Guide. SAS Institute.
Sato, K.; Kadota, Y. and Shirasu, K. 2019. Plant immune responses to parasitic nematodes. Frontiers in Plant Science. 10(2):1-14. Doi: 10.3389/fpls.2019.01165.
SIAP. 2019. Servicio de Información Agropecuaria y Pesquera. Anuario estadístico de la producción agrícola. Secretaría de Agricultura y Desarrollo Rural (SADER). Ciudad de México. https://nube.siap.gob.mx/cierreagricola/.
Triviño, G. C. 2004. Tecnología biológica para el manejo del nematodo agallador de raíces Meloidogyne spp. en tomate. Boletín técnico (109). Estación Experimental Boliche, Guayaquil. Ecuador. 15 p.
Uddin, K. M.; Shukor, J. A.; Hossain, S. M.; Altaf, N. M.; Eaqub, A. M. and Rahman, M. M. 2014. Purslane weed (Portulaca oleracea): a prospective plant source of nutrition, omega-3 fatty acid, and antioxidant attributes. The Scientific World Journal. 23(2):1-6. Doi: 10.1155/2014/951019.
Villar-Luna, E.; García, E. J.; Gómez, R. O.; Rojas, M. R. I. y Zavaleta, M. E. 2015. Defense gene expression in root galls induced by Nacobbus aberrans in CM334 chilli plants. Helminthologia. 52(1):77-82.
Villar-Luna, E.; Gómez, R. O.; Rojas, M. R. I. and Zavaleta, M. E. 2016. Presence of Meloidogyne enterolobii on jalapeño pepper (Capsicum annuum L.) in Sinaloa, México. Helminthologia. 53(2):155-160.
Vrain, T. C. 1977. A technique for the collection of larvae of Meloidogyne spp. and a comparison of eggs and larvae as inocula. Journal of Nematology. 9(3):49-51.
Wuyts, N.; Swennen, R. and De Wael, D. 2006. Effects of plant phenylpropanoid pathway products and selected terpenoids and alkaloids on the behavior of the plant-parasitic nematodes Radopholus similis, Pratylenchus penetrans and Meloidogyne incognita. Nematology. 8(1):89-101. Doi:10.1163/156854106776179953.
Yang, G.; Zhou, B.; Zhang, X.; Zhang, Z.; Wu, Y.; Zhang, Y.; Lü, S.; Zou, Q.; Gao, Y. and Teng, L. 2016. Effects of tomato root exudates on Meloidogyne incognita. Plos One. 11(4):1-16. Doi: 10.1371/journal.pone.0154675.
Zhou, Y.; Xin, H.; Rahman, K.; Wang, S.; Peng, C. and Zhang, H. 2015. Portulaca oleracea L.: a review of phytochemistry and pharmacological effects. BioMed Research International. 4:1-11. Doi: 10.1155/2015/925631.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


