Fermentación sólida de Metarhizium robertsii: sustrato y condiciones de cultivo en la producción de conidios y la eficacia biológica
DOI:
https://doi.org/10.29312/remexca.v16i3.3596Palabras clave:
Metarhizium robertsii Xoch 8.1, Tenebrio molitor, conidios, control biológico, infectividadResumen
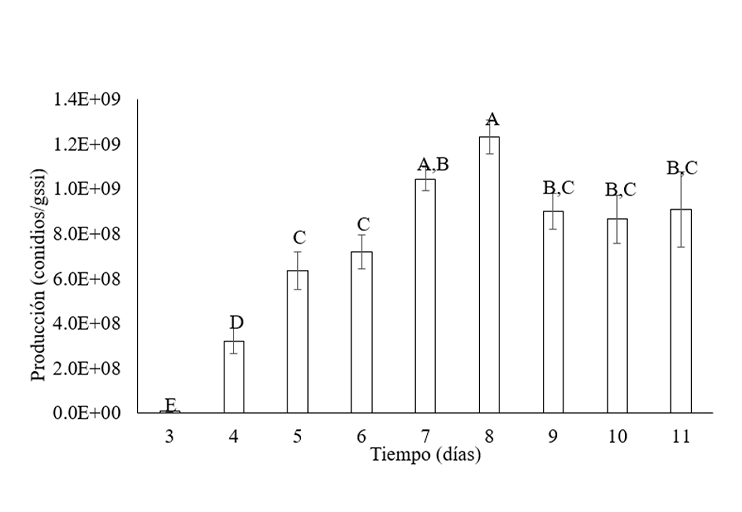
La implementación de conidios de hongos entomopatógenos representa una alternativa con ventajas en comparación con los insecticidas químicos. Su producción puede llevarse a cabo en sustratos económicos. Se examinaron las condiciones de cultivo, que incluyen sustratos, temperatura, humedad y tasa de aireación, para la producción de conidios de Mr Xoch8.1 en cultivo sólido, la investigación se realizó en Ecatepec de Morelos, Estado de México, en 2022. Se llevó a cabo un análisis de la calidad de los conidios a nivel de laboratorio, considerando la germinación, viabilidad e infectividad. Se realizó un perfil de conidiación durante 11 días de cultivo de la cepa Mr Xoch8.1 en fermentación sólida. La mayor producción de conidios se observó a los ocho días. Se evaluó la producción en diferentes sustratos, destacando la producción con arroz blanco. La temperatura de incubación a 28 °C resultó la más adecuada. La ausencia de aireación forzada generó la mayor producción. La humedad inicial del 60% condujo a una producción alta de conidios. La germinación y viabilidad de los conidios fueron del 93% y 57%, respectivamente. En términos de infectividad, se logró una mortalidad del 60% en gusano de la harina. La producción de conidios de Mr Xoch8.1 en fermentación sólida es una alternativa sustentable, mediante el uso de sustratos económicos y condiciones controladas, como una temperatura de 28 °C, humedad del 60% y ausencia de aireación forzada. Estas condiciones permiten una alta producción de conidios con buena germinación, viabilidad e infectividad, demostrando su potencial como agente de control biológico.
Descargas
Citas
Alcantara-Vargas, E.; Espitia-López, J.; Garza-López, P. M. and Angel-Cuapio, A. 2020. Conidia production and quality of entomopathogenic strains of the genus Metarhizium anisopliae, isolated in agricultural zones of the State of Mexico. México. Revista Mexicana de Biodiversidad. (91):1-11. Doi.org/10.22201/ib.20078706e.2020.91.2912.
Angel-Cuapio, A. and Loera, O. 2016. Uso de residuos agroindustriales como texturizantes para la producción de hongos entomopatógenos en cultivo en estado sólido. México. Mexican Journal of Biotechnology. 1(1):21-33.
Angel-Cuapio, A.; Figueroa-Montero, A.; Favela-Torres, E.; Viniegra-González, G.; Perraud-Gaime, I. and Loera, O. 2015. Critical values of porosity in rice cultures of Isaria fumosorosea by adding water hyacinth: effect on conidial yields and quality. México. Applied Biochemistry and Biotechnology. (177):446-457. Doi.org/10.1007/s12010-015-1754-4.
Arzumanov, T.; Jenkins, N. and Roussos, S. 2005. Effect of aeration and substrate moisture content on sporulation of Metarhizium anisopliae var. acridum. Reino Unido. Process Biochem. 40(3-4):1037-1042. Doi.org/10.1016/j.procbio.2004.03.013.
Benítez, T.; Rincón, A. M.; Limón, M. C. and Codon, A. C. 2004. Biocontrol mechanisms of Trichoderma strains. España. International Microbiology. 7(4):249-260.
Castillo-Castillo, H.; Rojas-Gutiérrez, L.; Espitia-López, J.; Garza-López, P.; Martínez-de Jesús, G.; Neria-González, I. and Angel-Cuapio, A. 2022. Texturizers increase the conidia production of Metarhizium anisopliae. México. Mexican Journal of Technology and Engineering. 2(1):22-29. https://doi.org/10.61767/mjte.001.2.2229.
Da Cunha, L. P.; Casciatori, F. P.; Cenço, L. I. and Thoméo, J. C. 2019. Production of conidia of the entomopathogenic fungus Metarhizium anisopliae ICB 425 in a tray bioreactor. Brasil. Bioprocess and Biosystems Engineering. 11(42):1757-1768. https://doi.org/10.1007/s00449-019-02172-z.
García-Cruz, I.; del Pozo-Núñez, E. M. and Hernández-Pérez, Y. 2019. Producción y conservación de conidios del aislado Ma-005 de Metarhizium anisopliae (Metsch.) Sorokin. Cuba. Centro Agrícola. 1(46):5-12.
García-Hernández, J.; Leyva-Morales, J. B.; Martínez-Rodríguez, I. E.; Hernández-Ochoa, M. I.; Aldana-Madrid, M. L.; Rojas-García, A. E.; Betancourt-Lozano, M.; Perez-Herrera, N. E. and Perera-Rios, J. H. 2018. Estado actual de la investigación sobre plaguicidas en México. México. Revista Internacional de Contaminación Ambiental. 34(1):29-60. Doi.org/10.20937/RICA.2018.34.esp01.03.
Guédez, C.; Castillo, C.; Cañizales, L. and Olivar, R. 2008. Biological control is a tool for sustaining and sustainable development. Venezuela. Academia. 7 (13):50-74.
Ibrahim, L.; Butt, T. M. and Jenkinson, P. 2002. Effect of artificial culture media on germination, growth, virulence and surface properties of the entomopathogenic hyphomycete Metarhizium anisopliae. Reino Unido. Mycological Research. 106(6):705-715. Doi.org/10.1017/S0953756202006044.
Jackson, M. A.; Dunlap, C. A. and Jaronski, S. T. 2010. Ecological considerations in producing and formulating fungal entomopathogens for use in insect biocontrol. Biocontrol. 55(1):129-145. Doi.org/10.1007/s10526-009-9240-y.
Jaronski, S. T. 2023. Mass production of entomopathogenic fungi-state of the art. In: mass production of beneficial organisms: invertebrates and Entomopathogens. Morales, J. A., Ed. 2nd. Academic Press. USA. 317-357 pp. Doi.org/10.1016/B978-0-12-822106-8.00017-8.
Jenkins, N. E. and Grzywacz, D. 2000. Quality control of fungal and viral biocontrol agents-assurance of product performance. Brazil. Biocontrol Science and Technology. 6(10):753-777. https://doi.org/10.1080/09583150020011717.
Latifian, M.; Rad, B.; Amani, M. and Rahkhodaei, E. 2013. Mass production of entomopathogenic fungi Beauveria bassiana (Balsamo) by using agricultural products based on liquid-solid diphasic method for date palm pest control. Iran. International Journal of Agriculture and Crop Sciences. 5 (19):2337-2341. https://doi.org/10.5897/AJB07.778.
López-Lastra, C. C.; Hajek, A. E. and Humber, R. A. 2002. Comparing methods of preservation for cultures of entomopathogenic fungi. Canada. Canadian Journal of Botany. 80 (10):1126-1130. https://doi.org/10.1139/b02-090.
Méndez-González, F.; Figueroa-Montero, A.; Loera, O.; Saucedo-Castañeda, G. and Favela-Torres, E. 2022. Addition of spherical-style packing improves the production of conidia by Metarhizium robertsii in packed column bioreactors. Reino Unido. Journal of Chemical Technology & Biotechnology. 97 (6):1517-1525. Doi.org/10.1002/jctb.6993.
Méndez-González, F.; Loera, O. and Favela-Torres, E. 2018. Conidia production of Metarhizium anisopliae in bags and packed column bioreactors. Brazil. Current Biotechnology. 7 (1):65-69. Doi.org/10.2174/2211550105666160926123350.
Muñiz, F. R. and Loera, O. 2006. The importance of strong inoculum in fungal cultures. México. Mexican Journal of Biotechnology. 1(1):120-134.
Nava-Pérez, E.; García-Gutiérrez, C.; Camacho-Báez, J. R. and Vázquez-Montoya, E. L. 2012. Bioplaguicidas: una opción para el control biológico de plagas. Ra Ximhai. 8(3):17-29. Doi.org/10.35197/rx.08.03.e2.2012.03.en.
Parveen, S. S. and Jeyarani, S. 2023. Laboratory evaluation of temperature effects on germination, radial growth and sporulation of entomopathogenic fungi and on their pathogenicity to red spider mite, Tetranychus urticae Koch. India. Indian Journal of Agricultural Research. 57 (3):376-382. Doi.org/10.1002/ps.622.
Prakash, G. B.; Padmaja, V. and Kiran, R. S. 2008. Statistical, optimization of process variables for the large-scale production of Metarhizium anisopliae conidiospores in solid-state fermentation. India. Bioresource Technology. 99(6):1530-1537. Doi.org/10.1016/j.biortech.2007.04.031.
Quesada-Moraga, E.; González-Mas, N.; Yousef-Yousef, M.; Garrido-Jurado, I. and Fernández-Bravo, M. 2023. Key role of environmental competence in successful use of entomopathogenic fungi in microbial pest control. España. Journal of Pest Science. 97(1):1-15. Doi.org/10.1007/s10340-023-01622-8.
Rodríguez-Gómez, D.; Loera, O.; Saucedo-Castañeda, G. and Viniegra-González, G. 2009. Substrate influence on physiology and virulence of Beauveria bassiana acting on larvae and adults of Tenebrio molitor. México. World Journal of Microbiology and Biotechnology. 25:513-518. Doi.org/10.1007/s11274-008-9917-x.
Ruiz-Sánchez, E.; Chan-Cupul, W.; Pérez Gutiérrez, A.; Cristóbal-Alejo, J.; Uch-Vazquez, B.; Tun-Suárez, J. M. and Munguía-Rosales, R. 2011. Crecimiento, esporulación y germinación in vitro de cinco cepas de Metarhizium y su virulencia en huevos y ninfas de Bemisia tabaci. México. Revista Mexicana de Micología. 33:9-15.
Shahid, A. A.; Rao, A. Q.; Bakhsh, A. and Husnain, T. 2012. Entomopathogenic fungi as biological controllers: new insights into their virulence and pathogenicity. Pakistán. Archives of Biological Sciences. 1(64):21-42. https://doi.org/10.2298/ABS1201021S.
Sharma, A.; Sharma, S. and Yadav, P. K. 2023. Entomopathogenic fungi and their relevance in sustainable agriculture: A review. Nepal. Cogent Food & Agriculture. 9(1):2180857. https://doi.org/10.1080/23311932.2023.2180857.
Tlecuitl-Beristain, S.; Viniegra-González, G.; Díaz-Godínez, G. and Loera, O. 2010. Medium selection and effect of higher oxygen concentration pulses on Metarhizium anisopliae var. lepidiotum conidial production and quality. México. Mycopathologia. 169(5):387-394. Doi.org/10.1007/s11046-009-9268-7.
Vishwanath, P. P.; Ahire, R. S.; Patil, S. R. and Pawar, S. B. 2021. Isolation, identification and evaluation of media for Metarhizium anisopliae growth and sporulation. India. Educational Research (IJMCER). 3 (4):250-258.
Wang, J. B.; Lu, H. L.; Sheng, H. and St. Leger, R. J. 2023. A Drosophila melanogaster model shows that fast growing Metarhizium species are the deadliest despite eliciting a strong immune response. Estados Unidos. Virulence. 14(1):2275493. Doi.org/10.1080/21505594.2023.2275493.
Xing, P.; Diao, H.; Wang, D.; Zhou, W.; Tian, J. and Ma, R. 2023. Identification, pathogenicity, and culture conditions of a new isolate of Cordyceps javanica (Hypocreales: Cordycipitaceae) from soil. Estados Unidos. Journal of Economic Entomology. 116(1):98-107. Doi.org/10.1093/jee/toac199.
Zimmermann, G. 2007. Review on safety of the entomopathogenic fungus Metarhizium anisopliae. Canadá. Biocontrol Science and Technology. 17(9):879-920. Doi.org/10.1002/ps.2780370410.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


