24-Epibrasinólido (24-EBL) como inductor de enraizamiento de esquejes de arándano azul en diferentes sustratos
DOI:
https://doi.org/10.29312/remexca.v14i1.3115Palabras clave:
Brasinoesteroide, Sustrato, Esquejes, Arándano AzulResumen
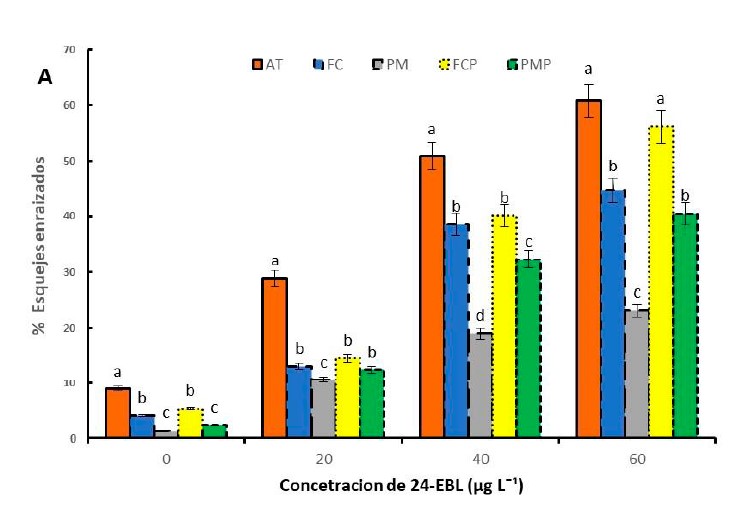
Los brasinoesteroides son fitohormonas esteroidales que se han utilizado ampliamente en la agricultura, se han realizado pocos estudios sobre el efecto que pueden tener para inducir la formación de raíces en esquejes de arándano (Vaccinium corymbosum). El objetivo de esta investigación fue evaluar el efecto del 24-epibrasinolide (24-EBL) a distintas concentraciones (0, 20, 40 y 60 μg L-1) y del sustrato sobre el enraizamiento de esquejes, se utilizó mezcla de arena de río y tezontle (AT), turba (Peat Moss®) y perlita (PMP), mezcla de fibra de coco y perlita (FCP), turba (Peat Moss®) (PM) y fibra de coco (FC). Las variables evaluadas a los 30 días después de establecido del experimento, fueron porcentaje de supervivencia (%SE), porcentaje de esquejes enraizados (%ER), número de raíces por esqueje (NR), longitud de raíz principal (LRP) y longitud total del sistema radicular (LTR). Los datos obtenidos se sometieron a análisis de varianza y comparación de medias con la prueba de Tukey. Los resultados mostraron que los esquejes de arándano con 24-EBL a una concentración de 60 μg L-1 en sustrato de AT presentan 84.7% de supervivencia y 67.76% de esquejes enraizado. Los esquejes expuestos a 24-EBL a una concentración 40 y 60 μg L-1 insertada en sustrato de mezcla de AT presentaron una mayor longitud de raíz y más raíces por esqueje en comparación con otros sustratos. Se concluye que el 24- EBL induce la formación de raíces en esquejes de plantas de arándano en sustrato de AT.
Descargas
Citas
A’saf, T. S.; Ajlouni, M. G.; Ayad, J. Y.; Othman, Y. A. and Hilaire, R. 2020. Performance of six different soilless green roof substrates for the mediterranean region. The Science of the Total Environment. 730:2-10. https://doi.org/10.1016/j.scitotenv.2020.139182. Acosta-Durán, C.; Vázquez-Benítez, N.; Villegas-Torres, O.; Vence, L. B. y Acosta-Peñaloza, D. 2014. Vermicomposta como componente de sustrato en el cultivo de Ageratum houstonianum Mill. y Petunia hybrida E. Vilm. En contenedor. Bioagro. 26(2):107-114. https://www.redalyc.org/pdf/857/85731100005.pdf.
Ahammed, G. J.; He, B. B.; Qian, X. J.; Zhou, Y. H.; Shi, K.; Zhou, J. Z.; Yu, J. Q. and Xia, X. J. 2017. 24-Epibrassinolide alleviates organic pollutants-retarded root elongation by promoting redox homeostasis and secondary metabolism in Cucumis sativus L. Environmental Pollution. 229:922-931. https://doi.org/10.1016/j. envpol.2017.07.076.
Ayub, R. A. and Pereira, A. B. 2020. Brassinosteroid combined with indolbutyric acid in blueberry micropropagation. J. Agric. Sci. 14(5):59-65. https://doi.org/10.5539/jas.v14n5p59.
Bannoud, F. and Bellini, C. 2021. Adventitious rooting in populus species: update and perspectives. Front. Plant Sci. 12:1-22. https://doi.org/10.3389/fpls. 2021.668837.
Bergonci, T.; Ribeiro, B.; Ceciliato, P. H. O.; Guerrero, A. J. C.; Silva, F. M. C. and Moura, D. S. 2014. Arabidopsis thaliana RALF1 opposes brassinosteroid effects on root cell elongation and lateral root formation. J. Exp. Bot. 65(8):2219-2230. https://doi.org/10.1093/ jxb/eru099.
Blythe, E. K.; Sibley, J. L.; Ruter, J. M. and Tilt, K. M. 2004. Cutting propagation of foliage crops using a foliar application of auxin. Sci. Hortic. 103(1):31-37. https://doi.org/10.1016/ j.scienta.2004.04.011. Braha, S. and Rama, P. 2018. Impact of the shoot maturity level on rooting, acclimatisation of green and semi-hardwood cuttings of the blueberry (Vaccinium corymbosum L.) cv Bluecrop stimulated with Indol butyric acid and naphthalene acetic acid. Agric, Forest. 64(3):79-87. https://doi.org/10.17707/AgricultForest.64.3.07.
Cárdenas-Navarro, R. y López-Pérez, L. 2011. Propagación vegetativa de rosa: efecto del sustrato, luminosidad y permanencia de la hoja. Sci. Agropec. 2(4):203-211. https://doi.org/ 10.17268/sci.agropecu.2011.04.02.
Castro-Restrepo, D. y Álvarez-Guzmán, J. A. 2013. Micropropagación clonal de tres genotipos mortiño, Vaccinium meridionale sw., por proliferación de yemas axilares. Actualidades biológicas. 35(99):145-160. Crespo-Crespo, G. M. R.; González-Eguiarte, D. R.; Rodríguez-Macías, R.; Ruiz-Corral, J. A. y Durán-Puga, N. 2018. Caracterización química y física del bagazo de agave tequilero compostado con biosólidos de vinaza como componente de sustratos para cultivos en contenedor. Rev. Internac. Contamin. Ambien. 34(3):373-382. https://doi.org/10.20937/ rica.2018.34.03.01.
De-Boodt, M. and Verdonck, O. 1972. The physical properties of the substrates in horticulture. Acta Hortic. 26:37-44. https://doi.org/10.17660/actahortic.1972.26.5. Díaz, L. A.; Fischer, G. and Pulido, S. P. 2012. La fibra de coco como sustituto de la turba en la obtención de plántulas de uchuva (Physalis peruviana L.). Rev. Colomb. Cienc. Hortíc. 4(2):153-162. https://doi.org/10.17584/rcch.2010v4i2.1236.
Gómez-Merino, F. C.; Trejo-Téllez, L. I.; García-Albarado, J. C. y Morales-Ramos, V. 2013. Lulo (Solanum quiroense Lamarck). Como nuevo elemento del paisaje en México: germinación y crecimiento en sustratos orgánicos. Rev. Mexic. Cienc. Agríc. 4(5):877-887. http://www.scielo.org.mx/scielo.php?script=sci-abstract&pid=S200709342013000900002 &lng=es&nrm=iso.
Hung, C. D. and Trueman, S. J. 2012. Cytokinin concentrations for optimal micropropagation of Corymbia torelliana and C. citriodora. Australian Forestry. 75(4):233-237. https://doi.org/ 10.1080/00049158.2012.10676407.
Hussain, M. A.; Fahad, S.; Sharif, R.; Jan, M. F.; Mujtaba, M.; Ali, Q.; Ahmad, A.; Ahmad, H.; Amin, N.; Ajayo, B. S.; Sun, C.; Gu, L.; Ahmad, I.; Jiang, Z. and Hou, J. 2020. Multifunctional role of brassinosteroid and its analogues in plants. Plant Growth Regulation. 92(2):141-156. https://doi.org/10.1007/s10725-020-00647-8.
Leitner, D.; Felderer, B.; Vontobel, P. and Schnepf, A. 2014. Recovering root system traits using image analysis exemplified by two-dimensional neutron radiography images of lupine. Plant Physiol. 164(1):24-35. https://doi.org/10.1104/pp.113.227892.
Luna-Fletes, J. A.; Cruz-Crespo, E. and Can-Chulim, A. 2021. Pumice stone, tezontle and nutritive solutions in the cultivation of cherry tomato. Terra Latinoam. 39:1-12. https://doi.org/10.28940/terra.v39i0.781.
Machado, R. M. A.; Bryla, D. R. and Vargas, O. 2014. Effects of salinity induced by ammonium sulfate fertilizer on root and shoot growth of highbush blueberry. Acta Hortic. 1017(49):407-414. https://doi.org/10.17660/actahortic.2014.1017.49.
Mouchel, C. F.; Osmont, K. S. and Hardtke, C. S. 2006. BRX mediates feedback between brassinosteroid levels and auxin signalling in root growth. Nature. 443(7110):458-461. https://doi.org/10.1038/nature05130.
Pagani, A.; Molinari, J.; Lavado, R. and Benedetto, A. 2015. Behavior impatient Wallerana Hook. F in alternative pot substrates: Mechanisms involved and research perspectives. J Plant Nutr. 38(14):2185-2203. https://doi.org/10.1080/01904167.2014.988357.
Pardo-Giménez, A. and Pardo-González, J. E. 2008. Evaluation of casing materials made from spent mushroom substrate and coconut fibre pith for use in production of Agaricus bisporus (Lange) Imbach. Rev. Investing. Agrar. 6(4):683-690. https://doi.org/10.5424/sjar/ 2008064-361.
Pego, R. G.; Fiorini, C. V. A.; Machado, A. F. L. and Gomes, M. V. S. 2019. Propagation of Streptosolen jamesonii (Benth) miers by stem cutting treated with IBA in different substrates. Ornamental Hortic. 25(1):26-33. https://doi.org/10.14295/oh.v25i1.1184.
Putrino, F. M.; Tedesco, M.; Bodini, R. B. and Oliveira, A. L. 2020. Study of supercritical carbon dioxide pretreatment processes on green coconut fiber to enhance enzymatic hydrolysis of cellulose. Bio. Technol. 309:1-7. https://doi.org/10.1016/j. biortech.2020.123387.
Rodriguez, S. C.; Vincent, C. and Rufus, I. 2019. Blueberry IPM: past successes and future challenges. Ann. Rev. Entomol. 64(1):95-114. https://doi.org/10.1146/annurev-ento-011118-112147. Sánchez-Córdova, T.; Aldrete, A.; Cetina-Alcalá, V. M. and López-Upton, J. 2008. Caracterización de medios de crecimiento compuestos por corteza de pino y aserrín. Madera y Bosques. 14(2):41-49.
Serna, M.; Hernández, F.; Coll, F. and Amorós, A. 2012. Brassinosteroid analogues effect on yield and quality parameters of field-grown lettuce (Lactuca sativa L.). Sci. Hortic. 143:29-37. https://doi.org/10.1016/j.scienta.2012.05.019.
SIAP. 2021. Sistema de Información Agroalimentaria y Pesquera, S. Panorama agroalimentario. gob.mx. https://www.gob.mx/siap/documentos/panorama-agroalimentario-2021.
Sun, L.; Feraru, E.; Feraru, M. I.; Waidmann, S.; Wang, W.; Passaia, G.; Wang, Z. Y.; Wabnik, K. and and Kleine-Vehn, J. 2020. PIN-LIKES coordinate brassinosteroid signaling with nuclear auxin input in Arabidopsis thaliana. Current Biol. 30(9):1579-1588. https://doi.org/10.1016/j.cub.2020.02.002. Vargas-Tapia, P.; Castellanos-Ramos, J. Z.; Sánchez-García, P.; Tijerina-Chávez, L.; López-Romero, R. M. y Ojodeagua-Arredondo, J. L. 2008. Caracterización física, química y biológica de sustratos de polvo de coco. Rev. Fitotec. Mexic. 31(4):375-375. Vázquez, M. N.; Guerrero, Y. R.; Noval, W. T.; González, L. M. and Zullo, M. A. T. 2019. Advances on exogenous applications of brassinosteroids and their analogs to enhance plant tolerance to salinity: A review. Austr. J. Crop Sci. 13(1):115-121. https://search.informit. org/doi/10.3316/informit.338566792578080.
Villegas-Monter, A.; Castro-Garibay, S. L. y Castro-Garibay, S. L. 2019. Enraizamiento de estacas en tres cultivares de arándano (Vaccinium corymbosum L.). AgroProductividad. 12(3):63-68. https://doi.org/10.32854/agrop.v0i0.1328.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2023 Revista Mexicana de Ciencias Agrícolas

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores(as) que publiquen en Revista Mexicana de Ciencias Agrícolas aceptan las siguientes condiciones:
De acuerdo con la legislación de derechos de autor, Revista Mexicana de Ciencias Agrícolas reconoce y respeta el derecho moral de los autores(as), así como la titularidad del derecho patrimonial, el cual será cedido a la revista para su difusión en acceso abierto.
Los autores(as) deben de pagar una cuota por recepción de artículos antes de pasar por dictamen editorial. En caso de que la colaboración sea aceptada, el autor debe de parar la traducción de su texto al inglés.
Todos los textos publicados por Revista Mexicana de Ciencias Agrícolas -sin excepción- se distribuyen amparados bajo la licencia Creative Commons 4.0 atribución-no comercial (CC BY-NC 4.0 internacional), que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Los autores/as pueden realizar otros acuerdos contractuales independientes y adicionales para la distribución no exclusiva de la versión del artículo publicado en Revista Mexicana de Ciencias Agrícolas (por ejemplo incluirlo en un repositorio institucional o darlo a conocer en otros medios en papel o electrónicos) siempre que indique clara y explícitamente que el trabajo se publicó por primera vez en Revista Mexicana de Ciencias Agrícolas.
Para todo lo anterior, los autores(as) deben remitir el formato de carta-cesión de la propiedad de los derechos de la primera publicación debidamente requisitado y firmado por los autores(as). Este formato debe ser remitido en archivo PDF al correo: revista_atm@yahoo.com.mx; revistaagricola@inifap.gob.mx.
Esta obra está bajo una licencia de Creative Commons Reconocimiento-No Comercial 4.0 Internacional.


